PTCLとは
疾患概要
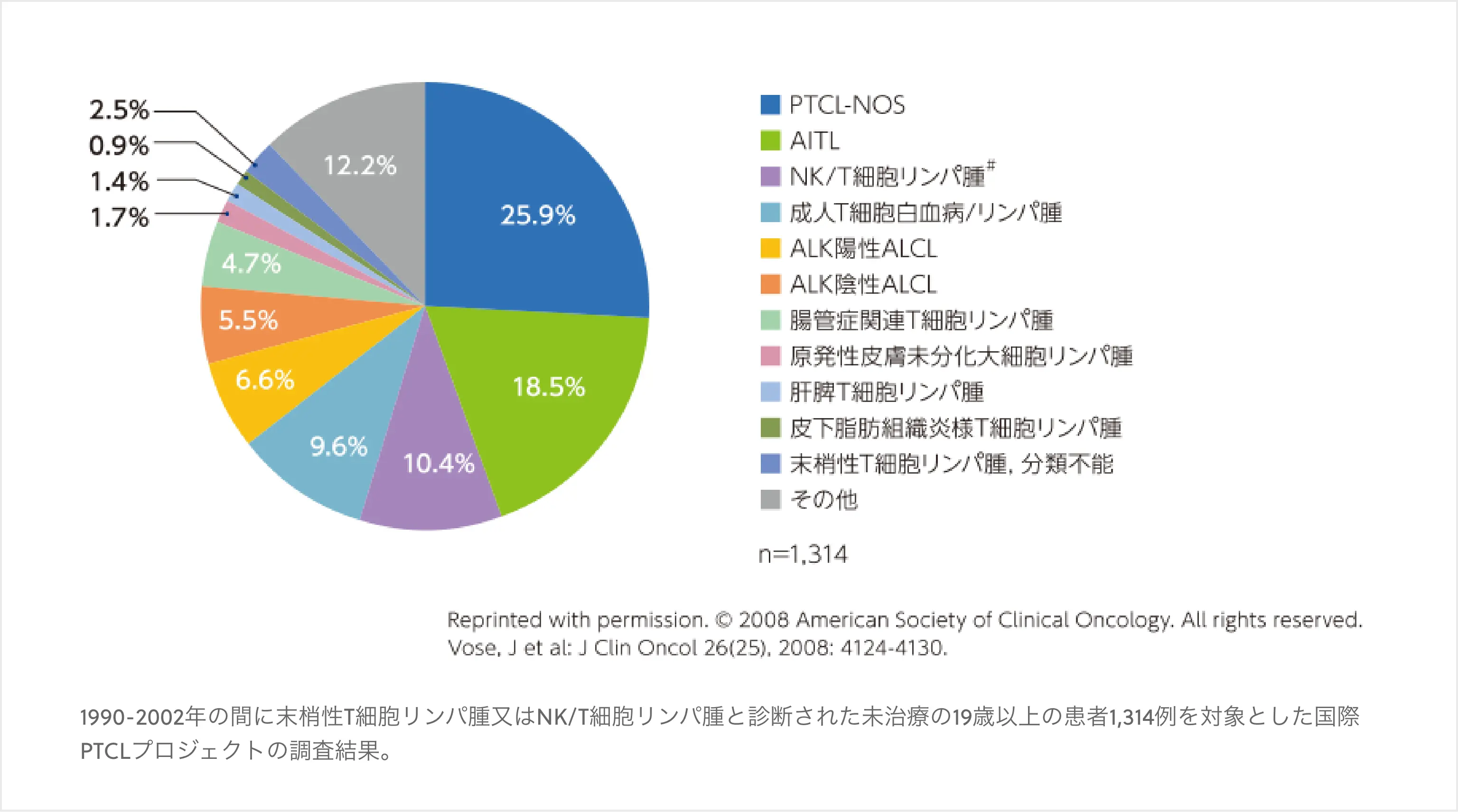
PTCLは、胸腺での分化・成熟を経て末梢臓器に移動したT細胞に由来する種々のリンパ系腫瘍の総称であり、月単位で進行するアグレッシブリンパ腫に分類される。 PTCLにはさまざまな病型が含まれる。そのうち、末梢性T細胞リンパ腫, 非特定型(PTCL-NOS)、血管免疫芽球性T細胞リンパ腫(AITL)、ALK陽性未分化大細胞型リンパ腫(ALCL)、ALK陰性ALCLなどが主要な病型である。ただし、PTCL-NOSは、他のいずれの病型にも属さないリンパ腫で構成される不均一な疾患の集合体であり、臨床病理学的に多様なものを含んでいる1)。 以下はPTCL又はNK/T細胞リンパ腫患者1,314例を対象とした国際PTCLプロジェクトの解析結果である。本プロジェクトでは、北米・ヨーロッパ・日本を含むアジアの3地域から収集されたPTCL又はNK/T細胞リンパ腫患者の病理検体についてレビューし、WHO分類に基づく診断を行った。その結果、各病型の相対頻度はPTCL-NOSが最も高く(25.9%)、次いでAITL(18.5%)、NK/T細胞リンパ腫(10.4%)、ALK陽性ALCL(6.6%)、ALK陰性ALCL(5.5%)であった(図1)2)。
図1 各病型の相対頻度
病型別の生存期間
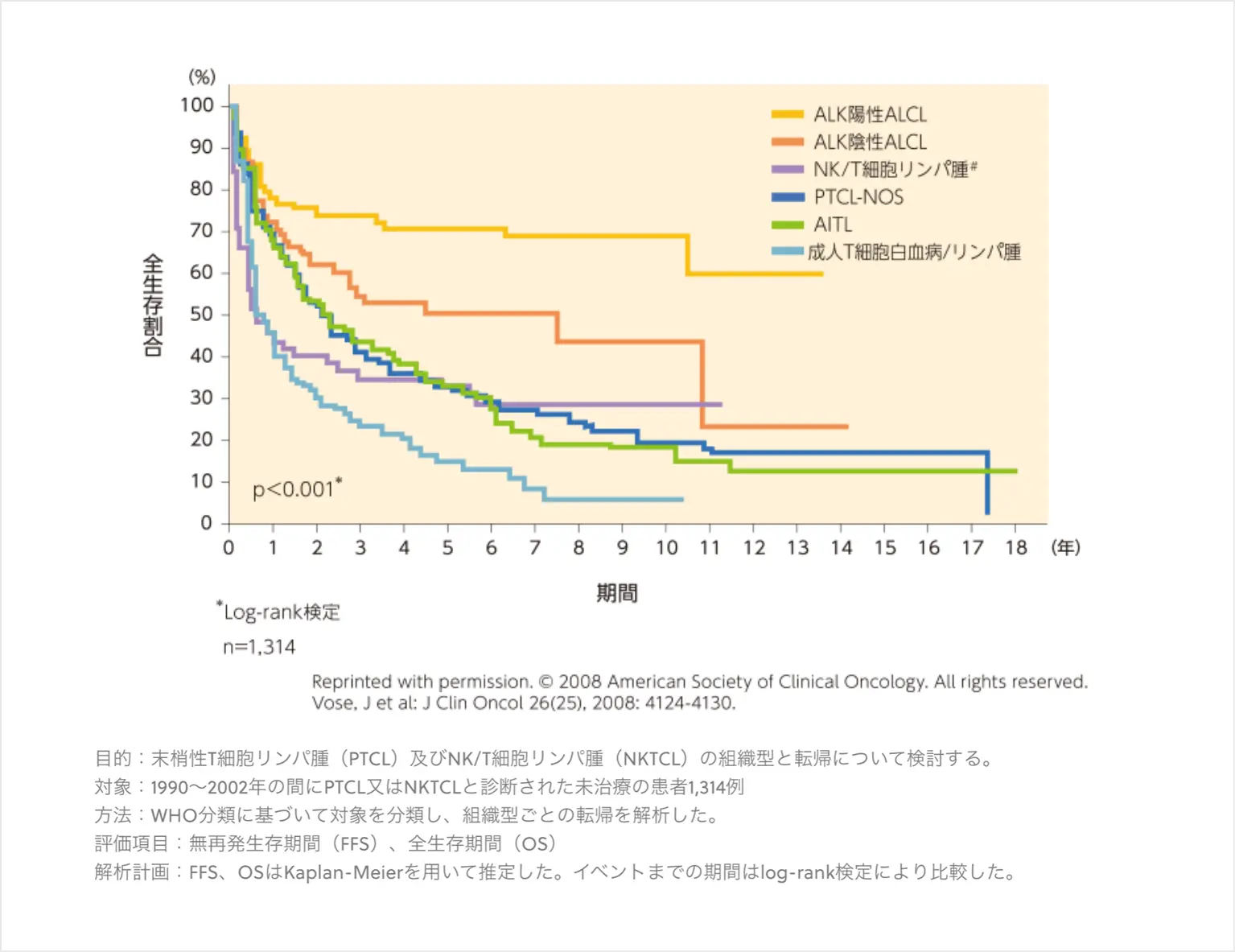
国際PTCLプロジェクトにおける全生存期間(OS)の解析結果より、ALK陽性ALCLを除いたその他のPTCLの病型は予後不良であることが示されている。5年全生存割合は、PTCL-NOSとAITLはともに32%、ALK陰性ALCLは49%であった(図2*)2)。各病型のOSより、病型診断が直接予後にかかわることが示唆される。
* リミテーション:論文中にリミテーションに関する記載なし
図2 OSのKaplan-Meier曲線
臨床症状
PTCLは進行期になってから発見されることが多く、リンパ節腫脹や全身症状としてB症状(発熱、寝汗、体重減少)が多くの患者でみられる。この他に、AITLでは脾腫や肝腫大、高免疫グロブリン血症、発疹などがみられ、ALK陽性ALCL、ALK陰性ALCLでは、リンパ節腫脹とB症状の中でも主に発熱がみられる1)。 また、PTCLでは皮膚病変が生じる場合がある。皮下脂肪組織炎様T細胞リンパ腫では皮下結節がみられる。皮膚病変の好発部位は下肢であるが、体幹・上肢、頭頚部にも病変があらわれる場合もある。隆起性病変や潰瘍化はまれである。節外性NK/T細胞リンパ腫, 鼻型では浸潤性紅斑、結節・腫瘤、皮下結節など多彩であり、潰瘍化する場合がある3)。
1)
Swerdlow SH, et al: WHO Classification of Tumours of Haematopoietic and Lymphoid Tissues. Revised 4th edition, p403-421, 2017
2)
Vose J, et al.: J Clin Oncol. 2008; 26: 4124-4130.
3)
斎田俊明 他編: 皮膚科サブスペシャリティーシリーズ 1冊でわかる皮膚がん, 文光堂, p335-342, 2011
PTCLの診断
検査・診断の流れ
PTCLなど悪性リンパ腫では、病理組織学的所見に基づき確定診断を行う。病理診断では、フローサイトメトリー(FCM)や免疫染色による免疫形質検索、染色体検査や遺伝子検査など、また、ALK陽性ALCLを疑う場合には、ALK遺伝子領域を挟んだプローブを用いたFISH検査を用いて総合的に判断する。 ただし、症例によっては病理組織学的所見のみでは診断が難しい一方、疾患に特徴的な臨床症状や血液検査所見などがみられる場合があるため、病理組織学的所見とこれらの所見を組み合わせて診断することが望ましいとされている1)。
病理所見
PTCL-NOSでは、腫瘍細胞の大きさが小型のものから大型のもの、また淡明細胞(clear cell)やホジキン様巨細胞を含むものがみられる2)。AITLの腫瘍細胞は淡明細胞の出現が特徴的で、その出現パターンは孤立散在性~びまん性とさまざまであり、数個から十数個程度の集塊を形成することが多い2)。ALCLの腫瘍細胞の形態は多様性に富み、大型で円形あるいは楕円形核に加え、腎臓様あるいはドーナツ様などと表現される特異な核形を示す細胞がみられる。また、巨核あるいは花冠状の多核細胞がみられることもある2)。
1)
坂田(柳元)麻実子: medicina. 2015; 52: 2115-2119.
2)
直江知樹 他編: WHO血液腫瘍分類 改訂版~WHO分類2017をうまく活用するために~, 医薬ジャーナル社, p350-363, 2018
PTCLの予後因子
予後因子
悪性リンパ腫は病型ごとに特徴的な予後を示すが、その他にも予後に影響を及ぼすさまざまな因子が報告されており、複数の予後因子を組み合わせた予後予測モデルが提唱されている。PTCLなどの予後予測モデルとしては国際予後指標(IPI)が有用である。その他に、病型に特異的な予後予測モデルとして、PTCL- NOSを対象としたPITなどが報告されている(表1)1-3)。これらの予後予測モデルは、実臨床における治療方針決定の際に必ずしも直接利用されていないが、患者に対する病状説明の際や各病型を対象とした臨床研究で患者背景を表現するためには有用と考えられる4)。
表1 PTCLに用いられる主な予後予測モデル
IPIと年齢調整IPI
IPIはドキソルビシンを含む併用化学療法を施行したアグレッシブ非ホジキンリンパ腫患者2,031例を対象に予後因子の解析を行い、開発された予後予測モデルである。IPIでは5つの予後因子〔①年齢(61歳以上)、②血清LDH(>正常値上限)、③Performance Status(PS)、④臨床病期(Ⅲ又はⅣ期)、⑤節外病変数(2ヵ所以上)〕の数により、低リスク、低中間リスク、高中間リスク、高リスクの4群に分け、予後予測モデルがつくられた(表2)。リスク群別の完全寛解割合はそれぞれ87%、67%、55%、44%、5年生存割合はそれぞれ73%、51%、43%、26%であった5)。
表2 IPIの予後因子
IPIでは60歳を基準として年齢により予後が異なることから、年齢調整IPIも提唱されている。
自家造血幹細胞移植のように若年者のみで高齢者は対象とならない治療や、高齢者のみを対象とした治療の臨床研究に用いられる4)。60歳以下の場合におけるリスク群別の5年生存割合は、低リスク、低中間リスク、高中間リスク、高リスクでそれぞれ83%、69%、46%、32%であった5)。
1)
NCCN Clinical Practice Guidelines in Oncology (NCCN Guidelines®)T-Cell Lymphomas, Version 2.2025 — May 28, 2025, PTCL-A
2)
造血器腫瘍診療ガイドライン第3.1版(2024年版)Web版, 金原出版, 2024
3)
飛内賢正 他監:悪性リンパ腫治療マニュアル(改訂第5版), 南江堂, p72-76, 2020
4)
森茂郎監:リンパ腫アトラス,文光堂,p42-48, 2014
5)
International Non-Hodgkin’s Lymphoma Prognostic Factors Project: N Engl J Med. 1993; 329: 987-994
PTCLの治療
PTCL治療のアルゴリズム
PTCL#の治療では、CHOP療法をはじめとする多剤併用化学療法の治療実績が多く報告されている。限局期では放射線療法の追加も選択できる1)。
ALK陽性ALCLにおける標準的な初回治療は、IPI2(低中間リスク)以上ではブレンツキシマブベドチン(BV)併用CHP(BV-CHP)療法が、IP10〜1(低リスク)ではCHOP/CHOP類似療法が推奨されるが、BV-CHP療法も選択可能である。PTCL-NOS、AITL、ALK陰性ALCLにおいても、CD30陽性であれば、BV-CHP療法が推奨される。ただし、従来どおりCHOP療法やCHOP類似療法も選択できる。CD30陰性であれば、初回治療は、実績が多いCHOP療法やCHOP類似療法が推奨される。また、臨床試験への参加も推奨される。PTCLでは予後の改善を目指した新規治療薬、移植療法の臨床試験が多く実施されている。これらへの参加は重要な治療選択肢の1つである1)2)。
造血幹細胞移植は、正常な造血幹細胞を移植して治療を行う方法である。主に、患者自身の細胞を使用する自家造血幹細胞移植と、他人の細胞を使用する同種造血幹細胞移植がある。通常、造血幹細胞移植は大量化学療法を組み合わせて行われる3)。なお、初回治療に引き続く(up-front)自家移植は現時点では推奨治療とはいえず、臨床試験として実施することが望ましい。化学療法後に再発した場合や難治性の場合には、自家及び同種の造血幹細胞移植が考慮される1)。
# 造血器腫瘍診療ガイドラインでは、PTCLは、PTCL- NOS、AITL、ALK陽性ALCL、ALK陰性ALCLを対象として取り扱っている。本邦で頻度の高い成人T細胞白血病/リンパ腫と節外性NK/T細胞リンパ腫, 鼻型については別項で取り扱っている。皮膚T細胞リンパ腫に関しては、皮膚悪性腫瘍診療ガイドライン第3版 皮膚リンパ腫診療ガイドライン2020が作成されている。
救援療法
PTCLの救援療法では明確な標準療法がないため、さまざまなレジメンの中から選択される(表3)。
表3 救援療法に用いられるレジメン例
造血幹細胞移植
造血器腫瘍の患者に対する造血幹細胞移植は、標準的な化学療法による予後が不良と予測される場合に予後を改善するために行われる。自家移植は大量化学療法による抗腫瘍効果を狙った治療であるが、治療関連死亡率が数パーセント未満と比較的安全な治療である一方、病型や患者の状態によっては移植後の再発が多い4)。 化学療法後CR例に対して地固め療法としての自家造血幹細胞移植を施行した報告では、3年全生存割合73%との良好な治療成績の報告5)があるが、一方で3-5年全生存割合が48-56%といった報告6)7)もあり、一致した見解は得られていない。そのため、一般診療として行うことは推奨されていない。
2010年以降に登場した治療薬
PTCLの初回治療では、主にCHOP療法に代表されるアントラサイクリン系薬剤を含む多剤併用療法が多く用いられるが、一部の病型を除いてその効果は不十分である場合もある。また、これらの治療に奏効しない患者や、治療後に再発又は病勢進行した患者では治療選択に関するエビデンスが不足している。
このような背景から、再発又は難治性のPTCLに対する新たな治療薬の開発が強く望まれていた。 近年、再発又は難治性のPTCLに対して抗CCR4モノクローナル抗体モガムリズマブ(遺伝子組換え)#、微小管阻害薬結合抗CD30モノクローナル抗体ブレンツキシマブ ベドチン(遺伝子組換え)#が承認され、さらにプリンヌクレオシドホスホリラーゼ(PNP)阻害剤フォロデシン、メトトレキサート類似の葉酸代謝拮抗剤プララトレキサート、ヒストン脱アセチル化酵素(HDAC)阻害剤ロミデプシン、ツシジノスタット#、バレメトスタットトシル酸塩#、インターロイキン-2(IL-2)とジフテリア毒素の部分配列からなる融合タンパク質デニロイキン ジフチトクス (遺伝子組換え)#、有機ヒ素製剤 ダリナパルシン が承認されている(表4)。
# モガムリズマブ(遺伝子組換え)はCCR4陽性の成人T細胞白血病リンパ腫、再発又は難治性のCCR4陽性のPTCL、再発又は難治性の皮膚T細胞性リンパ腫、ブレンツキシマブ ベドチン(遺伝子組換え)はCD30陽性のホジキンリンパ腫、CD30陽性のPTCL、ツシジノスタット、バレメトスタットトシル酸塩は再発又は難治性の成人T細胞白血病リンパ腫、再発又は難治性のPTCL、デニロイキン ジフチトクス(遺伝子組換え)は再発又は難治性のPTCL、再発又は難治性の皮膚T細胞性リンパ腫に対して承認されている。
表4 2010年以降に承認されたPTCLに対する治療薬
1)
日本血液学会 編: 造血器腫瘍診療ガイドライン 第3.1版(2024年版)Web版, 金原出版, 2024
2)
日本リンパ網内系学会 編: 若手医師のためのリンパ腫セミナー –エキスパートによる講義録, 南江堂, p101-109, 2012
3)
飛内賢正 監: 血液のがん 悪性リンパ腫・白血病・多発性骨髄腫, 講談社, p44-45, 2015
4)
菊池昌弘 他: 症例検討を通して学ぶ悪性リンパ腫診療の実際 -リンフォーマ井⼾端会議から学んだこと-, メディカルレビュー社, p71-75,2010
5)
Rodriguez J, et al.: Eur J Haematol. 2007; 79: 32-38
6)
Reimer P, et al.: J Clin Oncol. 2009; 27: 106-113
7)
d’Amore F, et al.: J Clin Oncol. 2012; 30: 3093-3099
2025年10月作成
承認番号:HE-JP-250004722