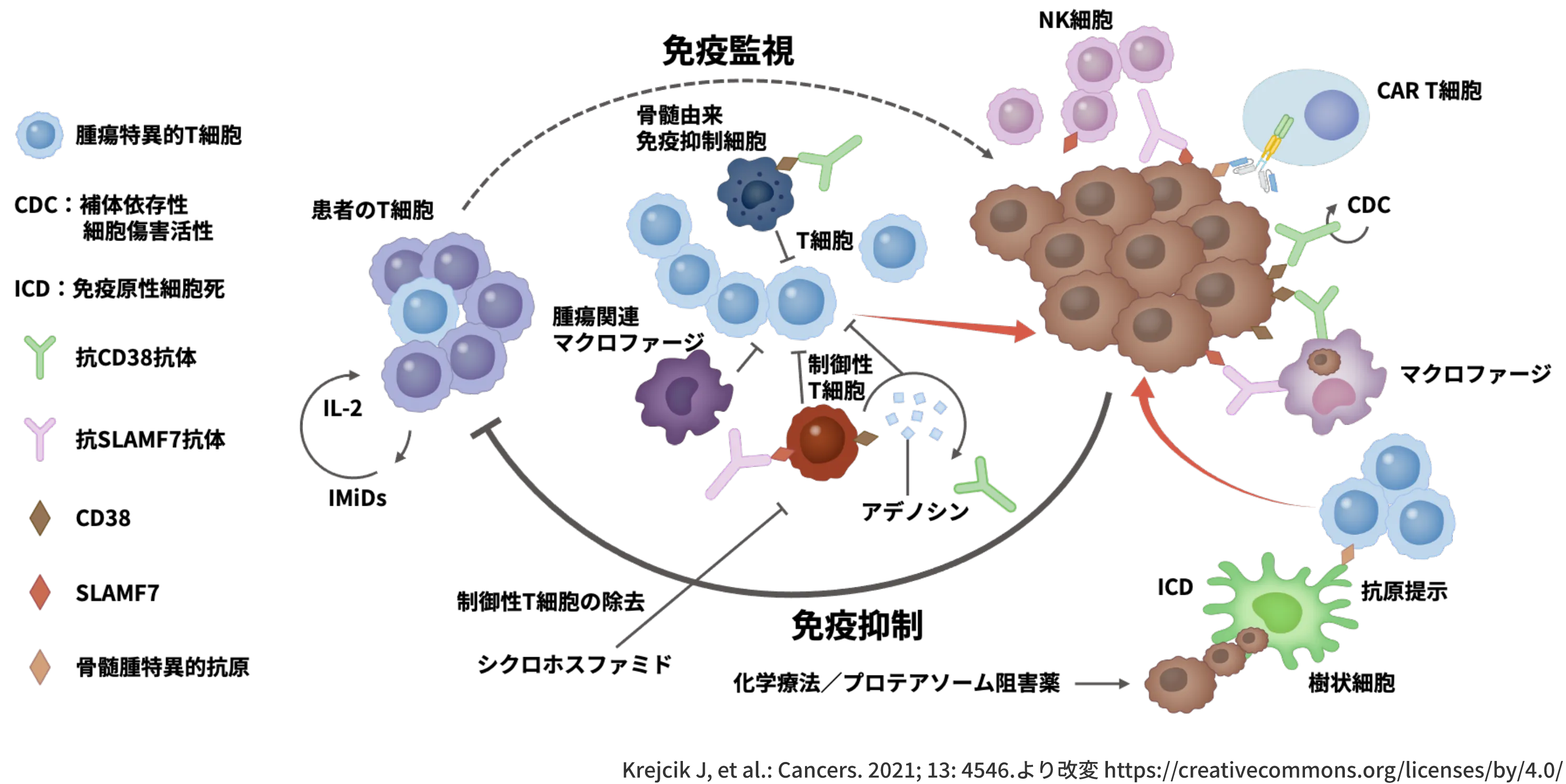
TiMEの解明が少しずつ進む中、CAR T細胞や二重特異性抗体などImmune-based Therapyの選択肢が増加しつつある1-3)
ここまで、MMにおける免疫抑制性のTiMEとその免疫抑制メカニズムについてお示ししました。 このように免疫抑制メカニズムが少しずつ明らかになってきた中、新たな治療概念として、腫瘍特異的T細胞の増殖や活性化を目指して、腫瘍細胞のみを標的とせず、TiMEを標的とした治療が複数提案されはじめています1-3)。
抗CD38抗体は、腫瘍細胞に発現するCD38に結合することで薬効を発揮しますが、その一方でCD38陽性免疫抑制細胞を除去する可能性が報告されています1)。
同様に、抗SLAMF7抗体も、腫瘍細胞に発現するSLAMF7に結合することで薬効を発揮しますが、その一方でSLAMF7陽性CD8陽性制御性T細胞を除去する可能性も考えられています。
また、免疫調節薬 (IMiDs) は抗腫瘍作用に加えて、免疫調節作用によりT細胞の増殖を誘導します1)。
CAR T細胞による治療では、T細胞はMHC分子を介さずに腫瘍細胞の表面分子との直接的な相互作用によって腫瘍細胞を認識し、抗腫瘍効果を示すことが可能となりました1-5)。
二重特異性モノクローナル抗体は、T細胞に発現するCD3と腫瘍細胞に発現するBCMAに結合する抗体であり、T細胞と腫瘍細胞を架橋するとともにT細胞を活性化し、抗腫瘍効果を発揮すると考えられています1)。
以降では、治療後のTiMEの変化と予後に関するデータを中心にお示しします。
図:TiMEの解明が少しずつ進む中、
CAR T細胞や二重特異性抗体などImmune-based Therapyの選択肢が増加しつつある
引用
1)
Krejcik J, et al.: Cancers. 2021; 13: 4546.
2)
Casey M and Nakamrua K.: ImmunoTargets Ther. 2021; 10: 247–260.
3)
Nakamura K, et al.: Blood. 2020; 136: 2731-2740.
4)
Slaney CY, et al.: Cancer Discov. 2018; 8: 924–934.
5)
Rafiq S, et al.: Nat Rev Clin Oncol. 2020; 17: 147-167.
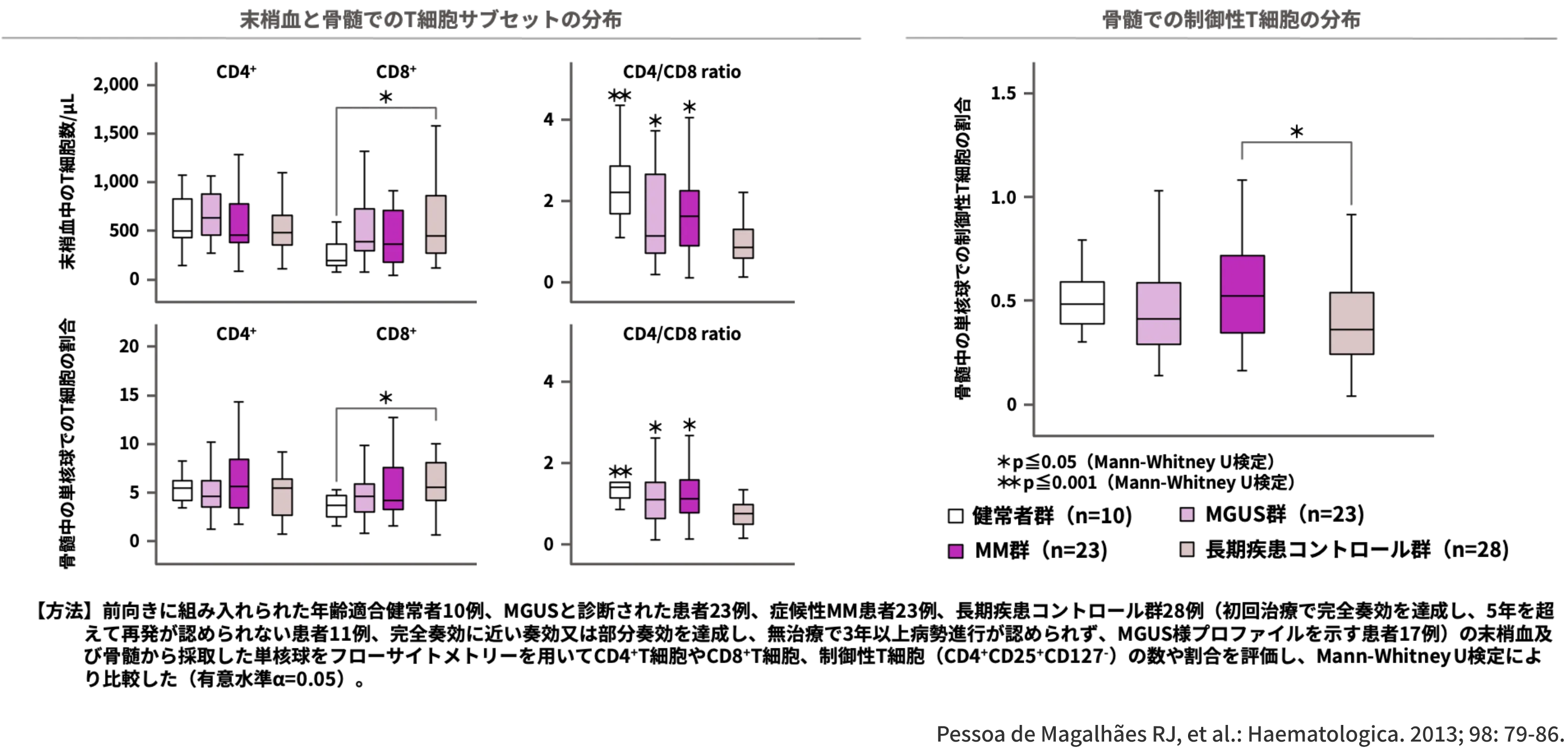
長期疾患コントロール群では、CD8+T細胞の割合が有意に高かった一方、
制御性T細胞の割合が有意に低かった
(それぞれp≦0.001、p≦0.05、Mann-Whitney U検定)1)
長期にわたって疾患がコントロールされているMM患者の免疫サブセットの特徴を評価したデータをお示しします。
なお、長期にわたって疾患がコントロールされているMM患者は、初回治療で完全奏効を達成して5年を超えて再発が認められない患者、又は完全奏効に近い奏効又は部分奏効を達成し、無治療で3年以上病勢進行が認められない患者(MGUS様プロファイルを示す患者)、と定義されました1)。
年齢適合健常者10例、新たにMGUSと診断された患者23例、症候性MM患者23例、長期疾患コントロール群28例の末梢血及び骨髄から採取したサンプルを対象に、CD4+T細胞やCD8+T細胞、制御性T細胞の割合をフローサイトメトリー法を用いて解析しました1)。
その結果、長期疾患コントロール群では末梢血と骨髄でCD8+T細胞の割合が有意に高い一方で、骨髄中の制御性T細胞の割合が有意に低かった(それぞれp≦0.001、p≦0.05、Mann-Whitney U検定)ことが示され1)、長期疾患コントロール群では免疫監視機構が改善している可能性が示唆されました。
図:長期疾患コントロール群では、CD8+T細胞の割合が有意に高かった一方、
制御性T細胞の割合が有意に低かった (それぞれp≦0.001、p≦0.05、Mann-Whitney U検定)
引用
1)
Pessoa de Magalhães RJ, et al.: Haematologica. 2013; 98: 79-86.
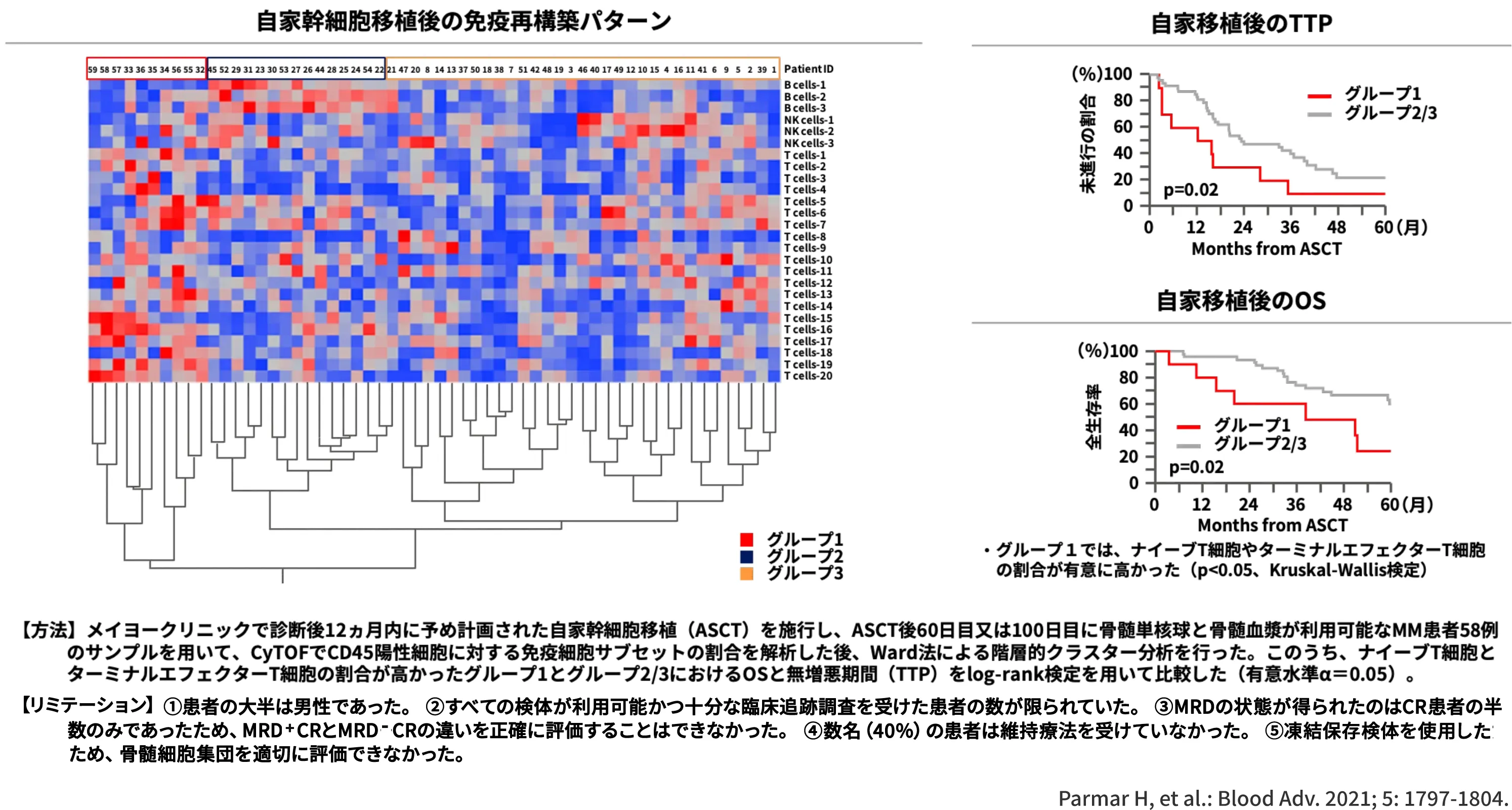
免疫再構築パターンのグループ1がグループ2/3と比較して、
TTPやOSが有意に短かった (いずれもp=0.02、log-rank検定)1)
また、最近では、自家幹細胞移植(ASCT)後の免疫再構築パターンとMM患者の予後の関係も報告されています。
診断後12ヵ月以内にASCTを施行したMM患者58例を対象に、ASCT後60日目又は100日目の腫瘍免疫微小環境の免疫サブセットを解析してクラスター分類を行ったところ、3つのクラスターに分類されました1)。
このうち、ナイーブT細胞とターミナルエフェクターT細胞の割合が高かったグループ1とそれ以外のグループ2/3における無増悪期間(TTP)とOSを比較した結果、グループ1でTTPとOSの有意な短縮が認められました (いずれもp=0.02、log-rank検定)1)。
このことから、ASCT後の免疫再構築パターンがMM患者の予後に関連する可能性が示唆されました。
図:免疫再構築パターンのグループ1がグループ2/3と比較して、
TTPやOSが有意に短かった (いずれもp=0.02、log-rank検定)
引用
1)
Parmar H, et al.: Blood Adv. 2021; 5: 1797-1804
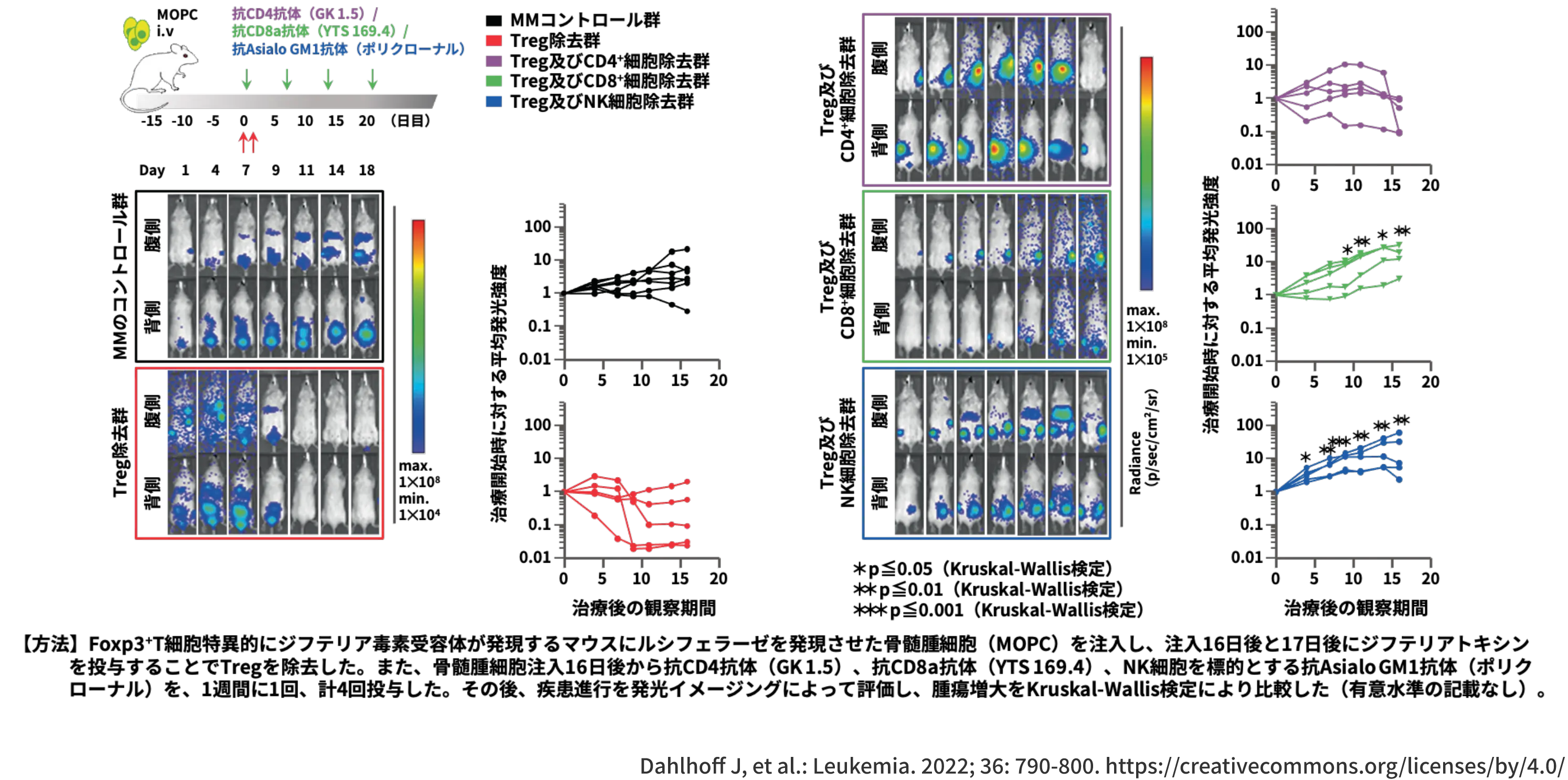
制御性T細胞(Treg)に加えてCD8+細胞やNK細胞を除去した群では
Tregのみを除去した群と比較して経時的に有意な腫瘍増大が観察された(マウス)1)
最後に、免疫細胞サブセットのうちTregに着目し、Treg除去後のエフェクター細胞に関する報告をお示しします1)。
本研究では、Foxp3+T細胞特異的にジフテリア毒素受容体が発現するマウスにルシフェラーゼを発現させた骨髄腫細胞を注入し、注入16日後と17日後にジフテリアトキシンを投与することでTregを除去しました1)。また、骨髄腫細胞注入16日後から抗CD4抗体、抗CD8a抗体、NK細胞を標的とする抗Asialo GM1抗体を毎週1回、計4回投与しました1)。疾患進行は発光イメージングを用いて評価しました1)。
その結果、Treg除去群の腫瘍は赤色のグラフで示す通りでしたが、Treg及びCD8+細胞を除去した群やTreg及びNK細胞を除去した群では、Tregのみを除去した群と比較して有意な腫瘍増大が10日目及び5日目以降にそれぞれ確認されました (p値及び検定法は下記図内に記載)1)。
すなわち、Tregを除去後のエフェクター細胞として、CD8+細胞やNK細胞の関与が示唆されました。
図:制御性T細胞(Treg)に加えてCD8+細胞やNK細胞を除去した群ではTregのみを除去した群と
比較して経時的に有意な腫瘍増大が観察された(p値及び検定法は下記図内に記載)(マウス)
引用
1)
Dahlhoff J, et al.: Leukemia. 2022; 36: 790-800.
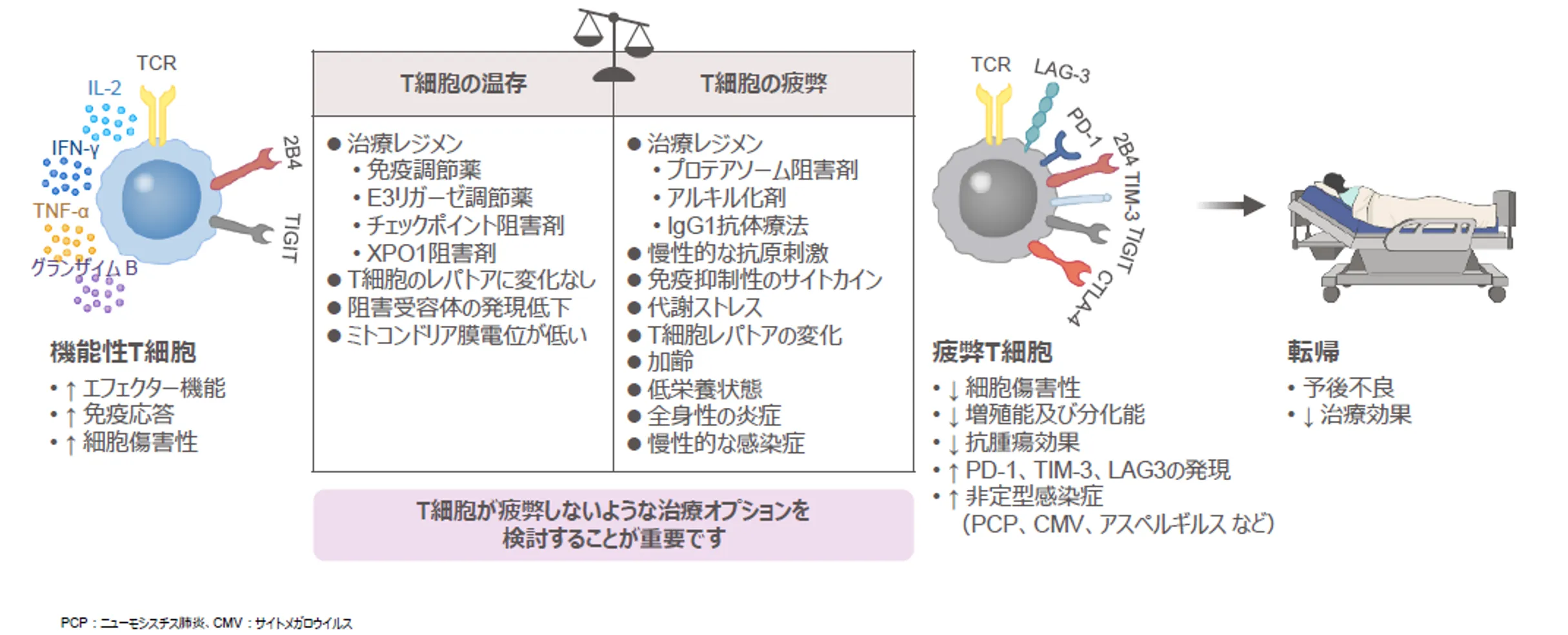
患者予後に影響するT-cell fitnessは様々な因子によって変化する1)
患者さんの予後に影響を及ぼすと考えられているT-cell fitnessは、前治療歴やTiMEに存在するその他の免疫細胞、加齢、全身状態(栄養状態や炎症、感染症)などの様々な要因に影響を受ける可能性があります。前治療歴に着目すると、図に示すような一部の薬剤はT-cell fitnessに影響をもたらす可能性があると考えられているため、これらを把握しておくことは重要です。
また、T細胞は持続的に抗原に暴露されることで疲弊するため、慢性的な抗原刺激もT-cell fitnessに影響すると考えられます。
MMの治療を行う際には、以上のことを理解したうえでT細胞が疲弊しないような治療オプションを検討することが重要です。
図:患者予後に影響するT-cell fitnessは様々な因子によって変化する
Binder AF, et al.: Front Immunol. 2023; 14: 1275329.
https://creativecommons.org/licenses/by/4.0/
引用
1)
Binder AF, et al.: Front Immunol. 2023; 14: 1275329.
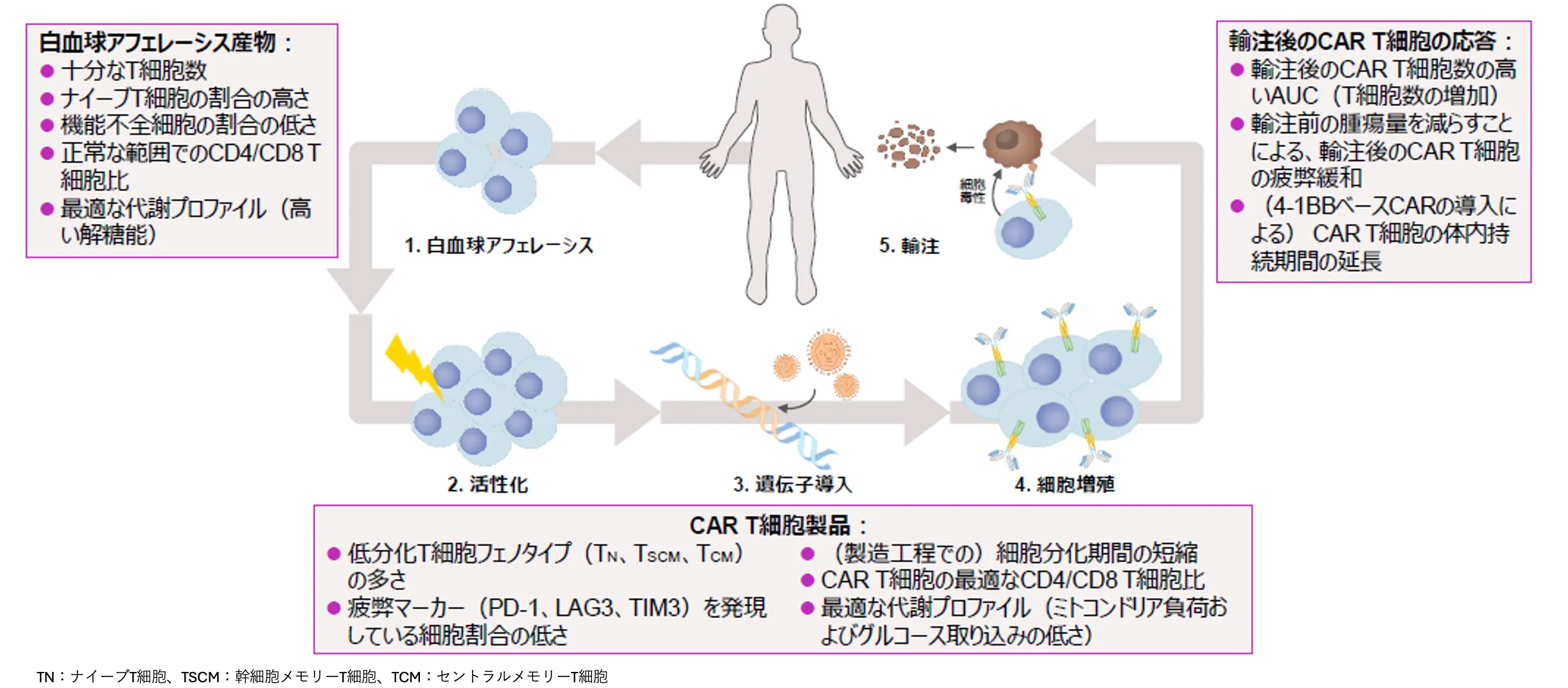
CAR T細胞療法の有効性に影響を与える可能性がある因子1)
CAR T細胞療法の有効性に影響を与える可能性がある因子として、白血球アフェレーシス産物では「十分なT細胞数」、「ナイーブT細胞の割合の高さ」、「正常な範囲でのCD4/CD8 T細胞比」などが挙げられます。
CAR T細胞製品では「低分化T細胞フェノタイプの多さ」、「製造工程での細胞分化期間の短縮」、「最適な代謝プロファイル」などが挙げられます。
また、投与後のCAR T細胞の応答では「輸注後の高いCAR T細胞数」、「輸注前の腫瘍量を減らすことによる、輸注後のCAR T細胞の疲弊緩和」、「4-1BBベースCARの導入によるCAR T細胞の体内持続期間の延長」など、様々な因子が挙げられます。
図:CAR T細胞療法の有効性に影響を与える可能性がある因子
Mehta PH, et al.: Front Immunol. 2021; 12: 780442.より改変
https://creativecommons.org/licenses/by/4.0/
引用
1)
Mehta PH, et al.: Front Immunol. 2021; 12: 780442.
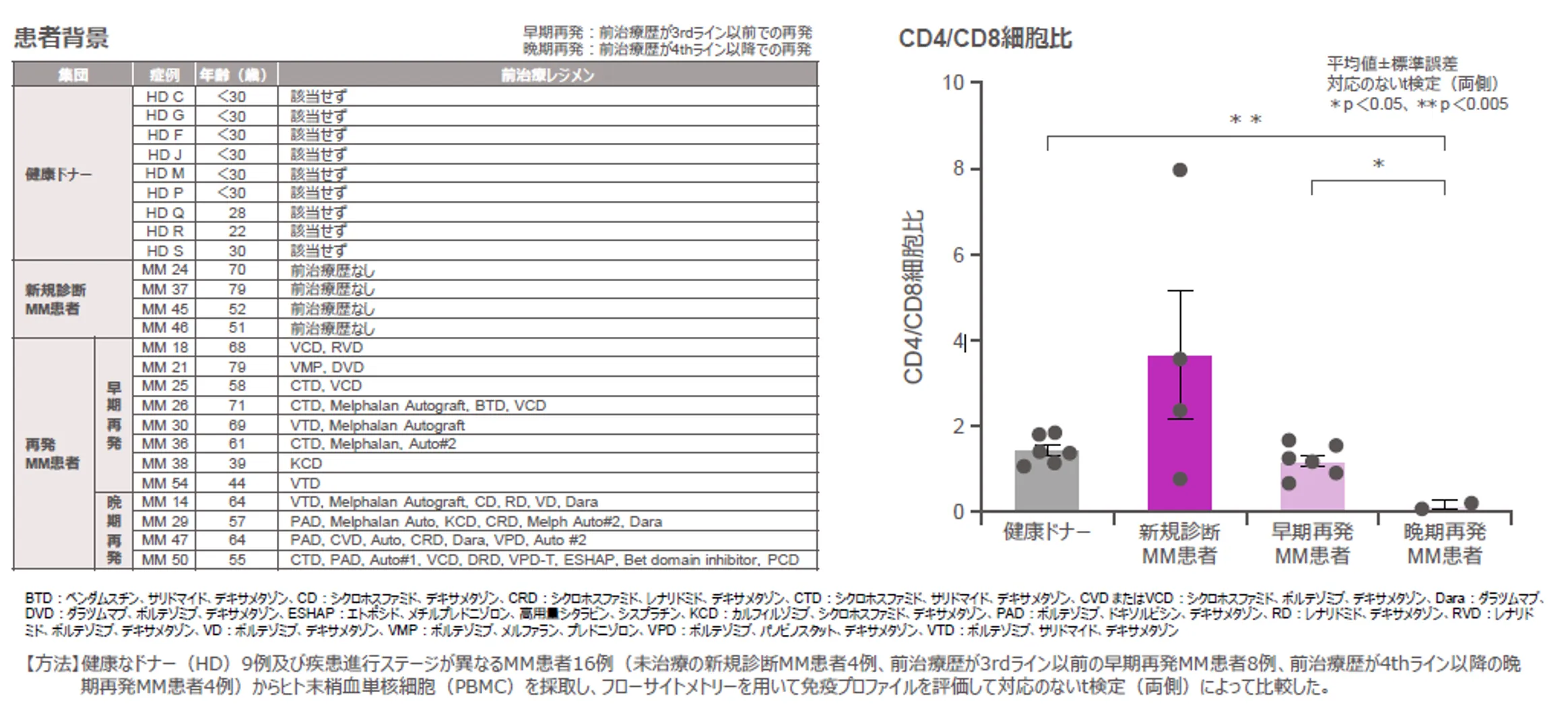
晩期再発MM患者のCD4/CD8細胞比は健康ドナー及び早期再発MM患者よりも有意に低いことが示された1)
健康ドナー9例および疾患進行ステージが異なるMM患者16例(未治療の新規診断MM患者4例、前治療歴が3ライン以前の早期再発MM患者8例、前治療歴が4ライン以降の晩期再発MM患者4例)を対象に、ヒト末梢血単核細胞(PBMC)を採取し、フローサイトメトリーを用いて免疫プロファイルを検討した研究をお示しします。
早期再発MM患者のCD4/CD8細胞比は健康ドナーとの間に有意差は認められませんでしたが、晩期再発MM患者のCD4/CD8細胞比は健康ドナー及び早期再発MM患者よりも有意に低いことが示されました(晩期再発MM患者 vs 健康ドナー:p<0.005、晩期再発MM患者 vs 早期再発MM患者:p<0.05、どちらも対応のないt検定[両側])。
図:晩期再発MM患者のCD4/CD8細胞比は健康ドナー及び早期再発MM患者よりも有意に低いことが示された(p値及び検定法は下記図内に記載)
MeteloAM, et al.: Cancer ResCommun. 2022; 2: 158-171.
https://creativecommons.org/licenses/by/4.0/
引用
1)
MeteloAM, et al.: Cancer Res Commun. 2022; 2: 158-171
2)
Mehta PH, et al.: Front Immunol. 2021; 12: 780442.
3)
McBride JA and Striker R.: PLoS Pathog. 2017; 13: e1006624.
まとめ
・MMの進展や病勢進行において、ゲノム異常の拡大のみではなく、腫瘍免疫微小環境(TiME)の抑制的な変化も観察されている
・抑制的なTiMEの形成には、エフェクター細胞の機能不全、免疫抑制細胞の産生や動員、可溶性の免疫抑制因子の3要因の相互作用が関わる
・TiMEの解明が少しずつ進む中、CAR T細胞や二重特異性抗体などImmune-based Therapyの選択肢が増加しつつある
・TiMEのMM病態への寄与やImmune-based Therapyの免疫学的作用機序のさらなる解明が期待される
多発性骨髄腫の進展や病勢進行において、ゲノム異常の拡大のみではなく、腫瘍免疫微小環境(TiME)の抑制的な変化も観察されています。
抑制的なTiMEが形成される原因としては、エフェクター細胞の機能不全、免疫抑制細胞の産生や動員、可溶性の免疫抑制因子の3要因の相互作用が関わっていると考えられています。
TiMEの解明が少しずつ進む中、新たな治療概念としてCAR T細胞や二重特異性抗体などImmune-based Therapyの選択肢が増加しつつあります。
今後は、TiMEの多発性骨髄腫の病態への寄与やImmune-based Therapyの免疫学的作用機序のさらなる解明が期待されます。
ここまでお示しした治療概念が日常診療のご参考になれば幸いです。
2025年11月作成
承認番号:HE-JP-250004620