ホーム / 診療・治療サポート-疾患関連情報 / 多発性骨髄腫の腫瘍免疫微小環境を標的とした治療:腫瘍免疫微小環境(TiME)
多発性骨髄腫の腫瘍免疫微小環境を標的とした治療:
腫瘍免疫微小環境(TiME)
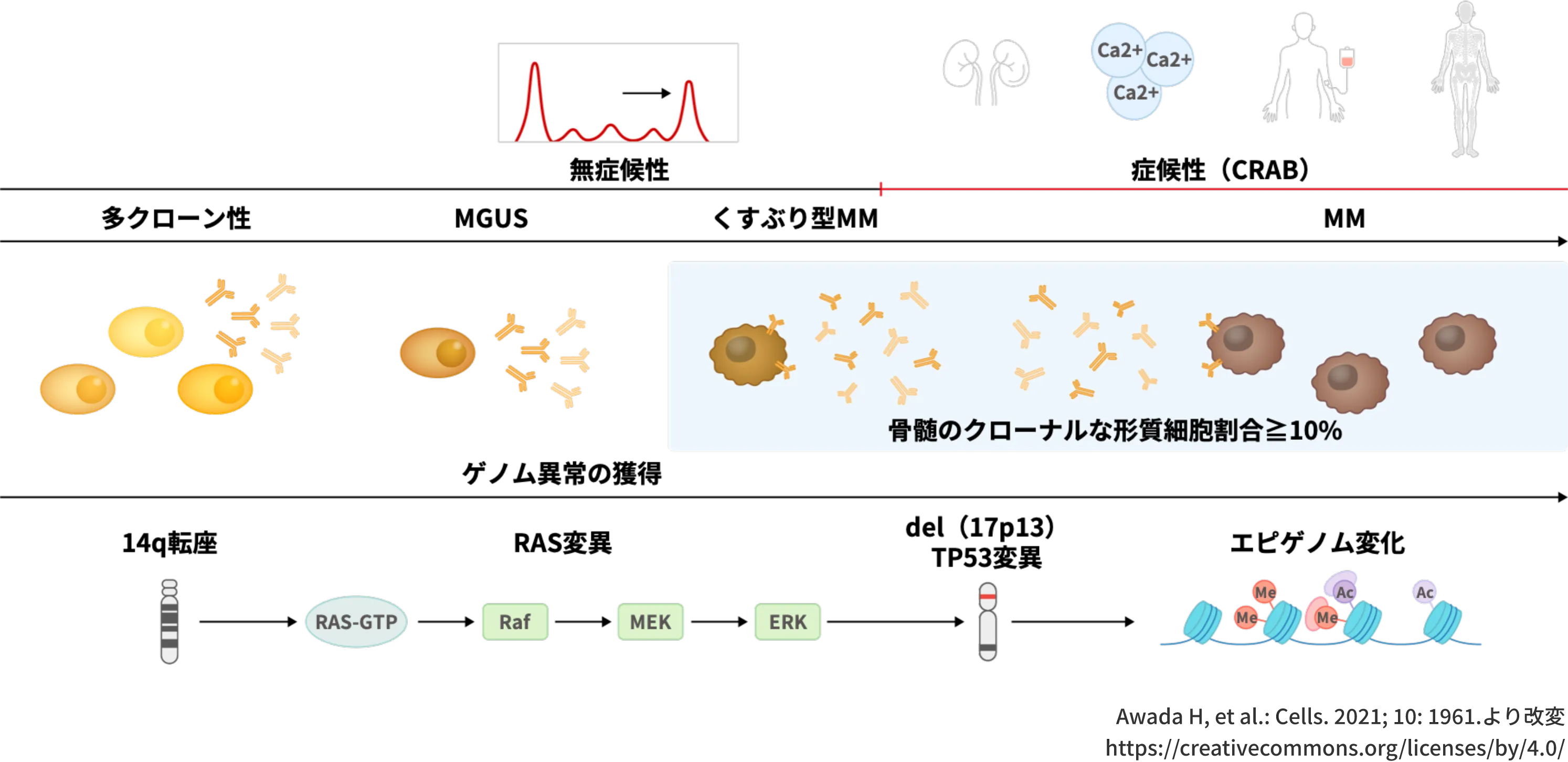
MM進展過程であるMGUSやくすぶり型MMでゲノム異常が認められている1,2)
多発性骨髄腫(MM)は、形質細胞の単クローン性(腫瘍性)増殖とその産物である単クローン性免疫グロブリン(M蛋白)の血清・尿中増加により特徴づけられる疾患です1)。
進展過程には意義不明の単クローン性ガンマグロブリン血症(MGUS)やくすぶり型MM(SMM)があり、高カルシウム血症、腎機能障害、貧血、骨破壊性病変(CRAB)のいずれかの臨床的症状が発現すると、症候性MMと診断され治療対象となります1,2)。
この進展過程において、骨髄腫細胞は段階的にゲノム異常やエピゲノム変化を獲得しますが、14q転座やRAS変異をはじめとしたMMでみられる多くのゲノム異常がMGUSやSMMの段階ですでに認められています2)。
図:MM進展過程であるMGUSやくすぶり型MMでゲノム異常が認められている
引用
1)
日本血液学会 編. 造血器腫瘍診療ガイドライン 2018年版補訂版, 2020; 金原出版.
2)
Awada H, et al.: Cells. 2021; 10: 1961.
3)
日本血液学会 編. 造血器腫瘍ゲノム検査ガイドライン 2021年度一部改訂版, 2021; 金原出版.
4)
Venes D, et al.: Taber’s Cyclopedic Medical Dictionary. 21st ed., 2009.
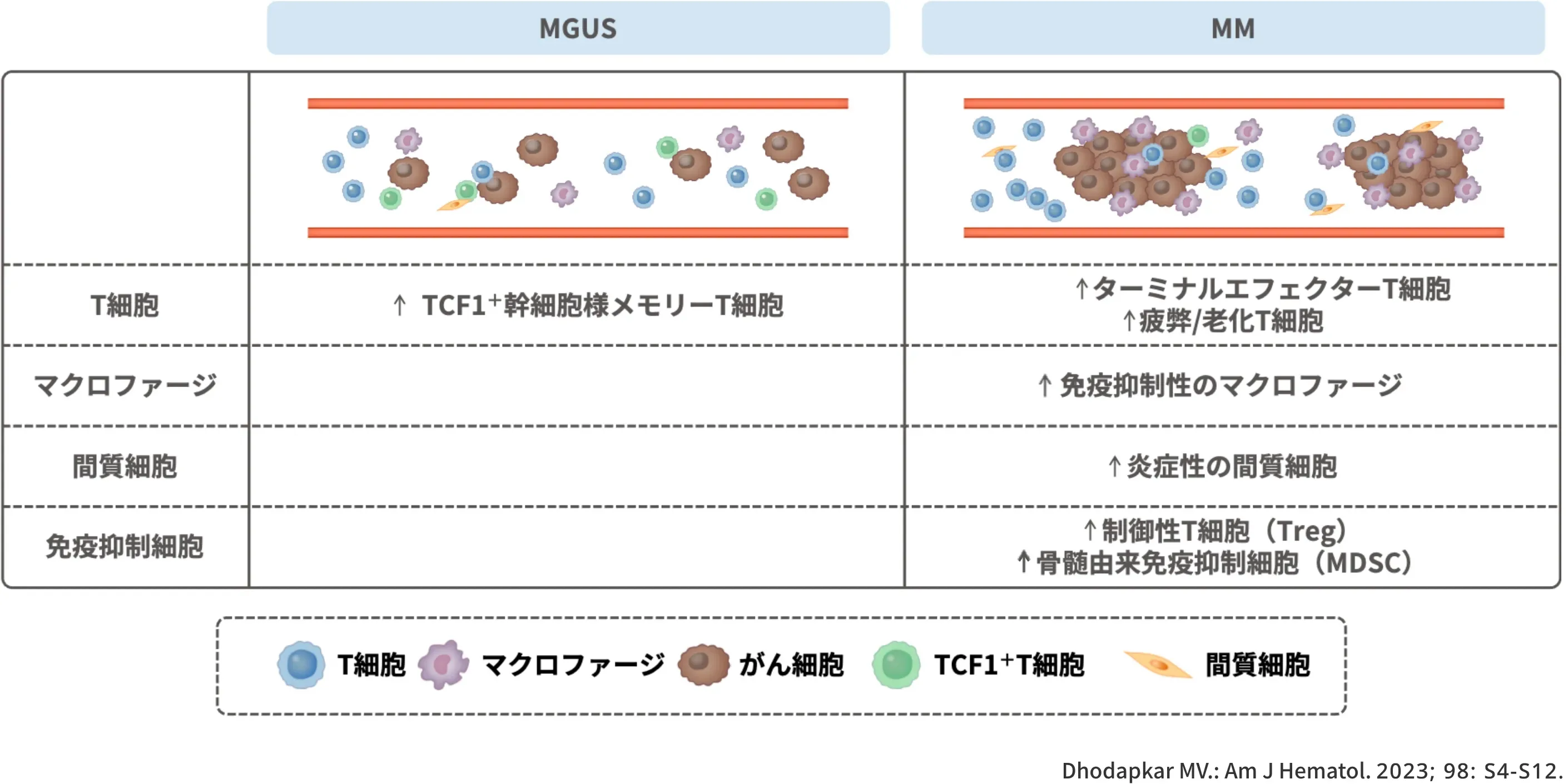
MGUSやMMにおける腫瘍免疫微小環境(TiME)の構成1)
MGUSやMMにおける腫瘍免疫微小環境(TiME)の構成についてお示しします。
MGUSの段階ではTCF1+幹細胞様メモリーT細胞が特徴的な構成要素の一つとして挙げられます。一方、MMに進展すると、ターミナルエフェクターT細胞や疲弊/老化T細胞、免疫抑制性のマクロファージ、炎症性の間質細胞、制御性T細胞(Treg)や骨髄由来免疫抑制細胞(MDSC)が特徴的な構成要素として挙げられます。
図:MGUSやMMにおける腫瘍免疫微小環境(TiME)の構成
引用
1)
Dhodapkar MV.: Am J Hematol. 2023; 98: S4-S12.
2)
Kim C, et al.: Int J Mol Sci. 2020; 21: 6497.
3)
Wang Y, et al.: J Leukoc Biol. 2021; 110: 1209-1223.
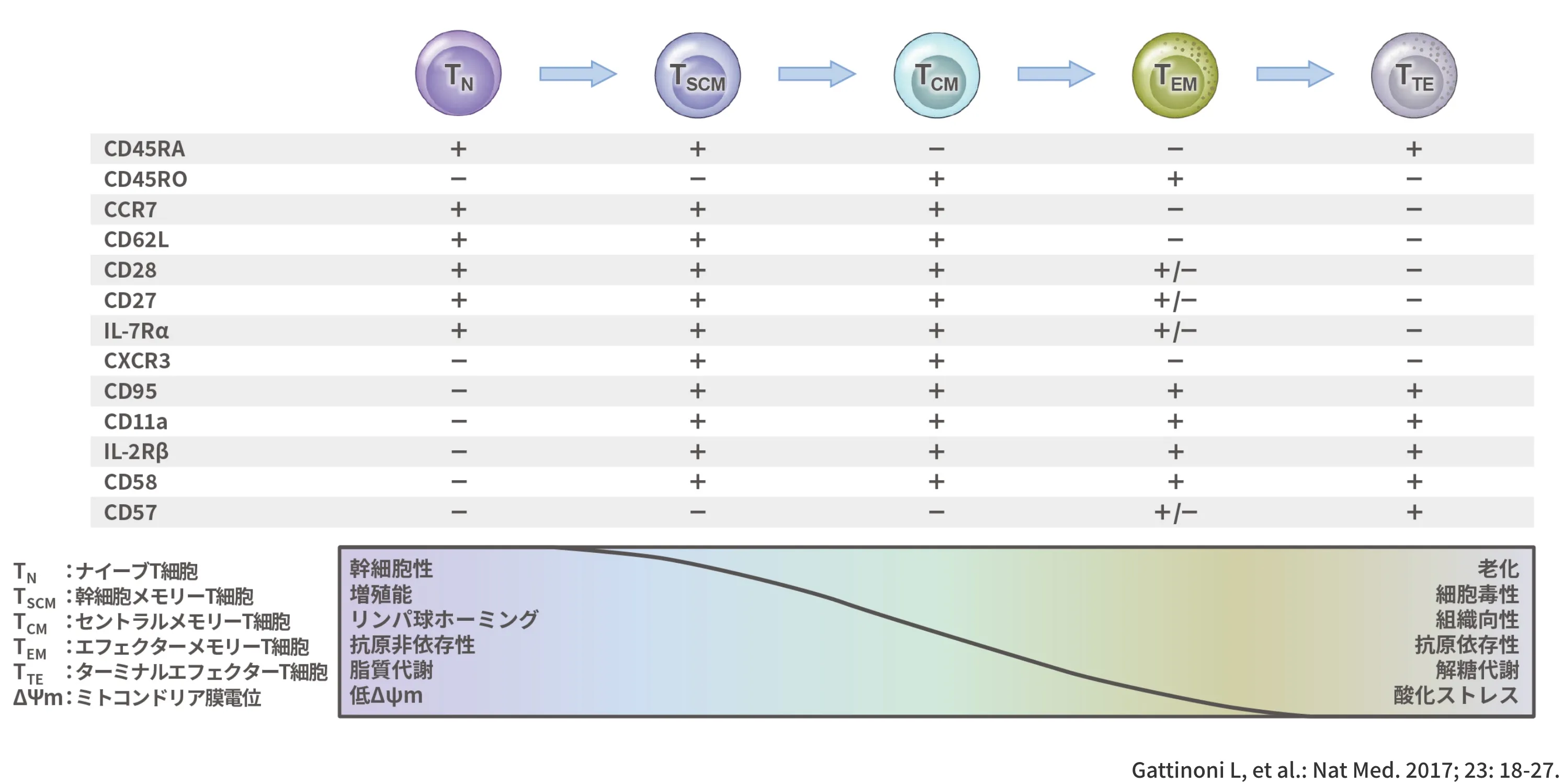
ヒトT細胞分化の階層モデル1)
抗原提示による活性化の後、ナイーブT細胞(TN)は徐々に多様なメモリーT細胞亜集団に分化し、最終的にはターミナルエフェクターT細胞(TTE)に分化します。T細胞サブセットは、表面マーカーの発現の組み合わせによって区別されます。TN細胞がTTE細胞に徐々に分化するにつれて、特定の機能的および代謝的特性を失うか獲得します。
TSCM細胞:幹細胞メモリーT細胞
TCM細胞 :セントラルメモリーT細胞
TEM細胞 :エフェクターメモリーT細胞
ΔΨm:ミトコンドリア膜電位
図:ヒトT細胞分化の階層モデル
引用
1)
Gattinoni L, et al.: Nat Med. 2017; 23: 18-27.
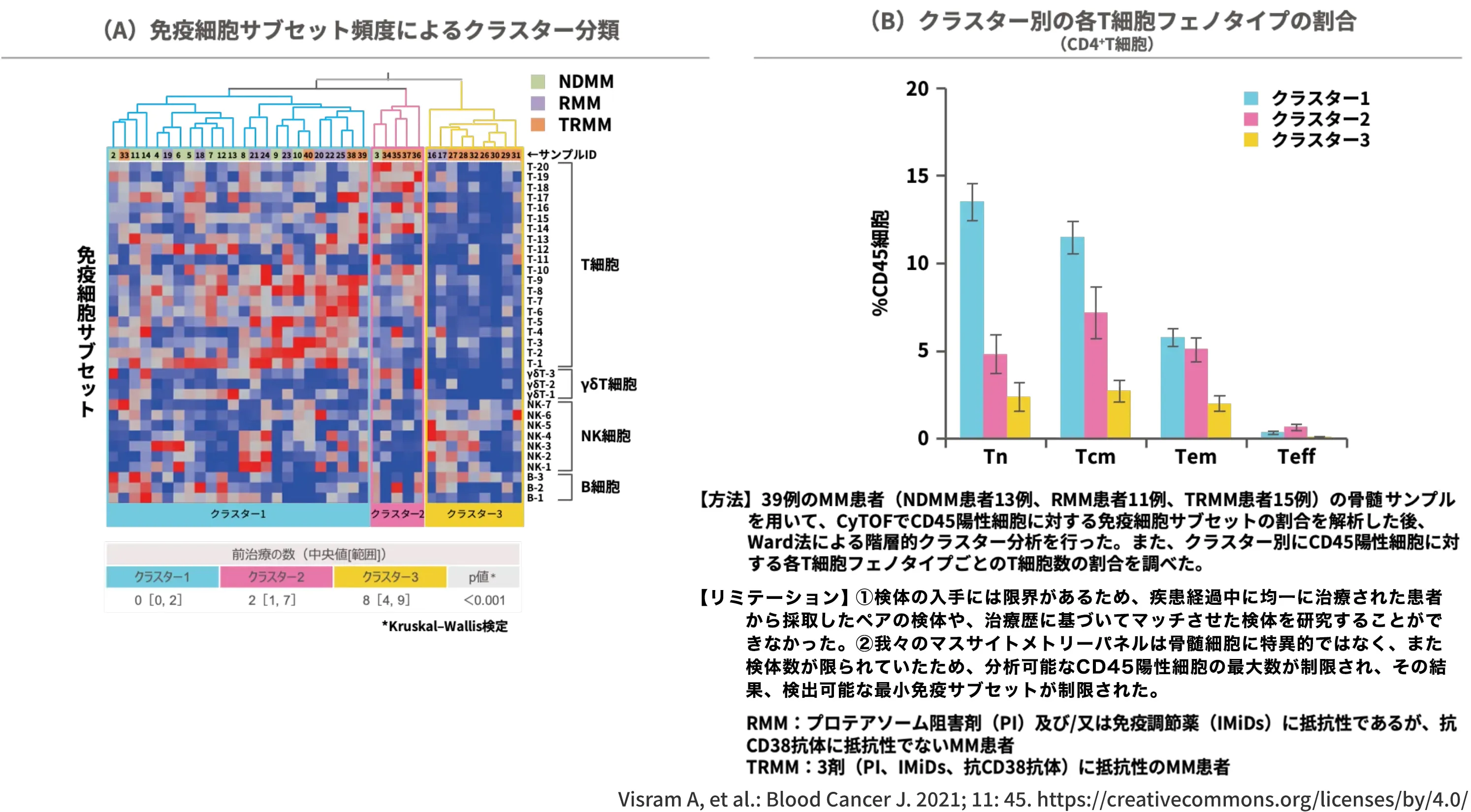
クラスター2/3はTriple-class Refractoryの患者群で主に構成され、
各T細胞フェノタイプ(Tn、Tcm、Tem、Teff)の割合は以下の通りであった1)
続いて、MM患者の免疫サブセット頻度からクラスター分類を行い、各クラスターの治療歴や前治療数、T細胞フェノタイプ毎のT細胞割合を解析した報告をお示しします。
方法は、NDMM患者、プロテアソーム阻害剤(PI)及び/又は免疫調節薬(IMiDs)に抵抗性であるが、抗CD38抗体に抵抗性でないRMM患者、PI、IMiDs、抗CD38抗体の3クラスに抵抗性のTRMM患者の骨髄サンプルを用いて、CyTOFでCD45陽性細胞に対する免疫細胞サブセットの割合を解析した後、階層的クラスター分析を行い、クラスター別にCD45陽性細胞に対する各T細胞フェノタイプの割合を調べました。
クラスター分析の結果、クラスター1がNDMMやRMM、クラスター2/3がTriple-class Refractoryの患者群で主に構成されていました。クラスター2の前治療数中央値は2で、クラスター3の8と比べて、前治療数が有意に少ない結果となりました。
また、クラスター別の各T細胞フェノタイプの割合は次項にお示しの通りの結果となりました。
図:クラスター2/3はTriple-class Refractoryの患者群で主に構成され、各T細胞フェノタイプ(Tn、Tcm、Tem、Teff)の割合は以下の通りであった
引用
1)
Visram A, et al.: Blood Cancer J. 2021; 11: 45.
2)
Newell EW, et al.: Nat Biotechnol. 2013; 31: 623-629.
3)
フリューダイム株式会社.: マスサイトメーター HeliosTM, a CyTOF® System
(https://www.fluidigm-japan.com/wp-content/uploads/2021/03/Helios-181011.pdf)(2025年7月アクセス)
MMの進展や病勢進行における腫瘍免疫微小環境(TiME)の重要性が示されている1-5)
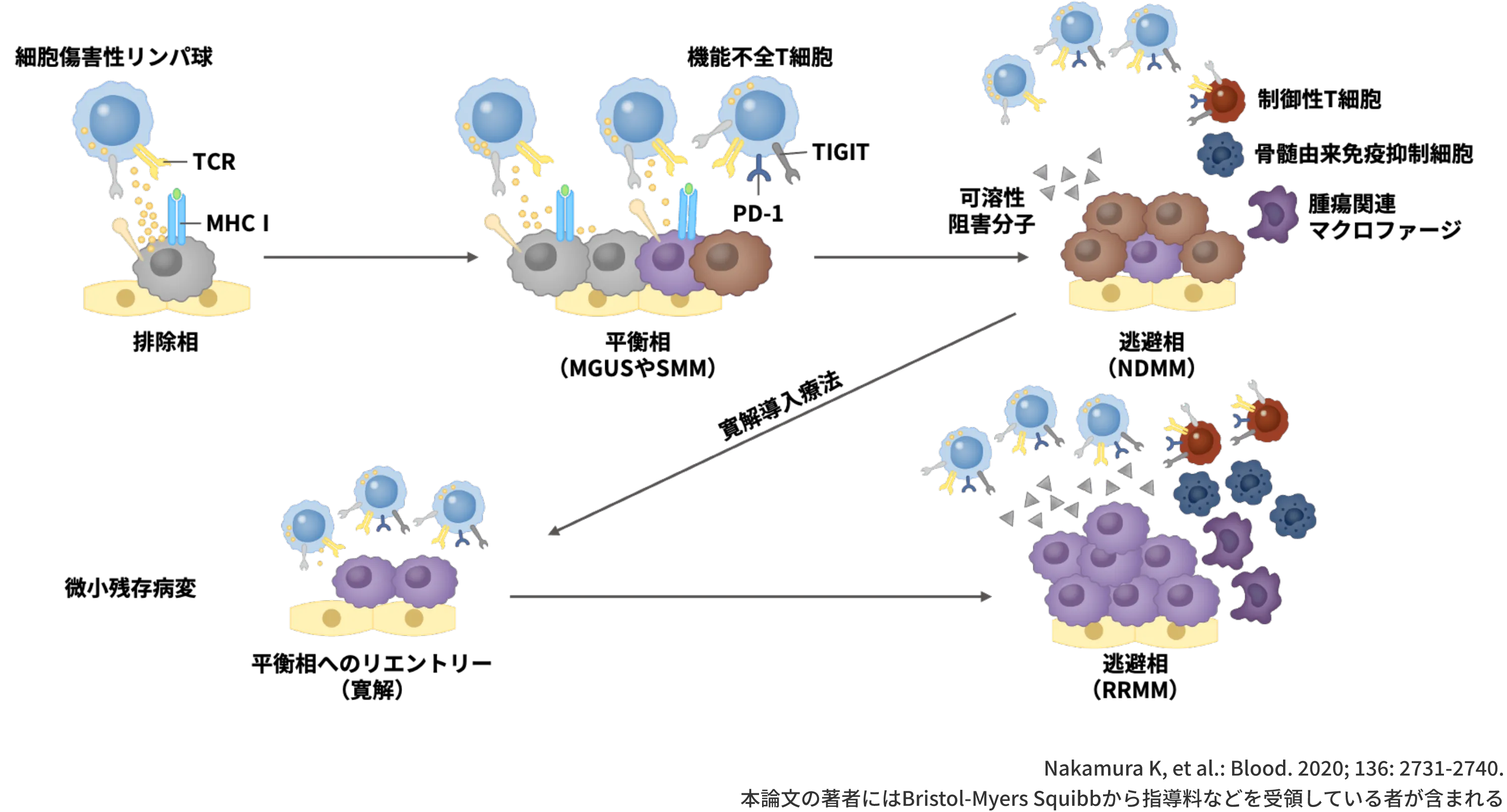
これまでお示しした通り、MMの進展や病勢進行に伴って免疫抑制性のTiMEが構築されますが、その過程をがん免疫編集の観点からお示しします。
がん免疫編集では、排除相、平衡相、逃避相の3つのステップで構成されており、その過程で腫瘍細胞自体のクローナルエボリューション及び/又は免疫微小環境の変化により、腫瘍細胞がImmune Escapeし(腫瘍細胞が免疫システムの監視をくぐり抜け)、MMの進展や病勢進行に至ると考えられています1-3)。
排除相は、ナチュラルキラー細胞やCD8+T細胞などの細胞傷害性リンパ球によって悪性化した細胞が排除されている状態です1-3)。
平衡相は、腫瘍細胞の増殖と免疫系による腫瘍細胞の排除が拮抗している状態で、MMの進展過程のうちMGUSやくすぶり型MMが該当すると考えられています1,2)。この段階では無症候なものの、すでに悪性形質転換の起こったクローンが存在しており、T細胞の機能低下が始まっている可能性があります1,2)。
NDMMに相当する逃避相は、腫瘍細胞の増加が免疫系による排除を上回り、腫瘍細胞の増加に有利な免疫抑制性のTiMEが構築されている状態です1-3)。この段階では、免疫応答を示すT細胞は減少して、制御性T細胞や骨髄由来免疫抑制細胞などの免疫抑制細胞が増加しているため、腫瘍細胞はImmune Escapeが可能な状態にあります1,3-5)。
その後、寛解導入療法の施行により平衡相へとリエントリーすることはありますが、再発して逃避相に至った場合(RRMM)、免疫抑制性のTiMEが再構築されると考えられています1)。
図:MMの進展や病勢進行における腫瘍免疫微小環境(TiME)の重要性が示されている
引用
1)
Nakamura K, et al.: Blood. 2020; 136: 2731-2740.
2)
中村恭平.: 臨床血液. 2021; 62: 1186-1194.
3)
Kalbasi A, et al.: J Clin Invest. 2013; 123: 2756–2763.
4)
Zavidij O, et al.: Nat Cancer. 2020; 1: 493-506.
5)
Bailur JK, et al.: JCI Insight. 2019; 5: e127807.
ヒト化マウスへのCD3陽性細胞を除去した患者由来(MGUS、無症候性MM、難治性MM、PCL)の骨髄単核球の異種移植後に骨髄腫細胞の生着や増殖が観察された (マウス)1)
MMの進展や病勢進行に関して、腫瘍免疫微小環境において、MGUSやMMでの形質細胞や骨髄腫細胞と非腫瘍細胞の相互作用に関して検討した報告をお示しします1)。
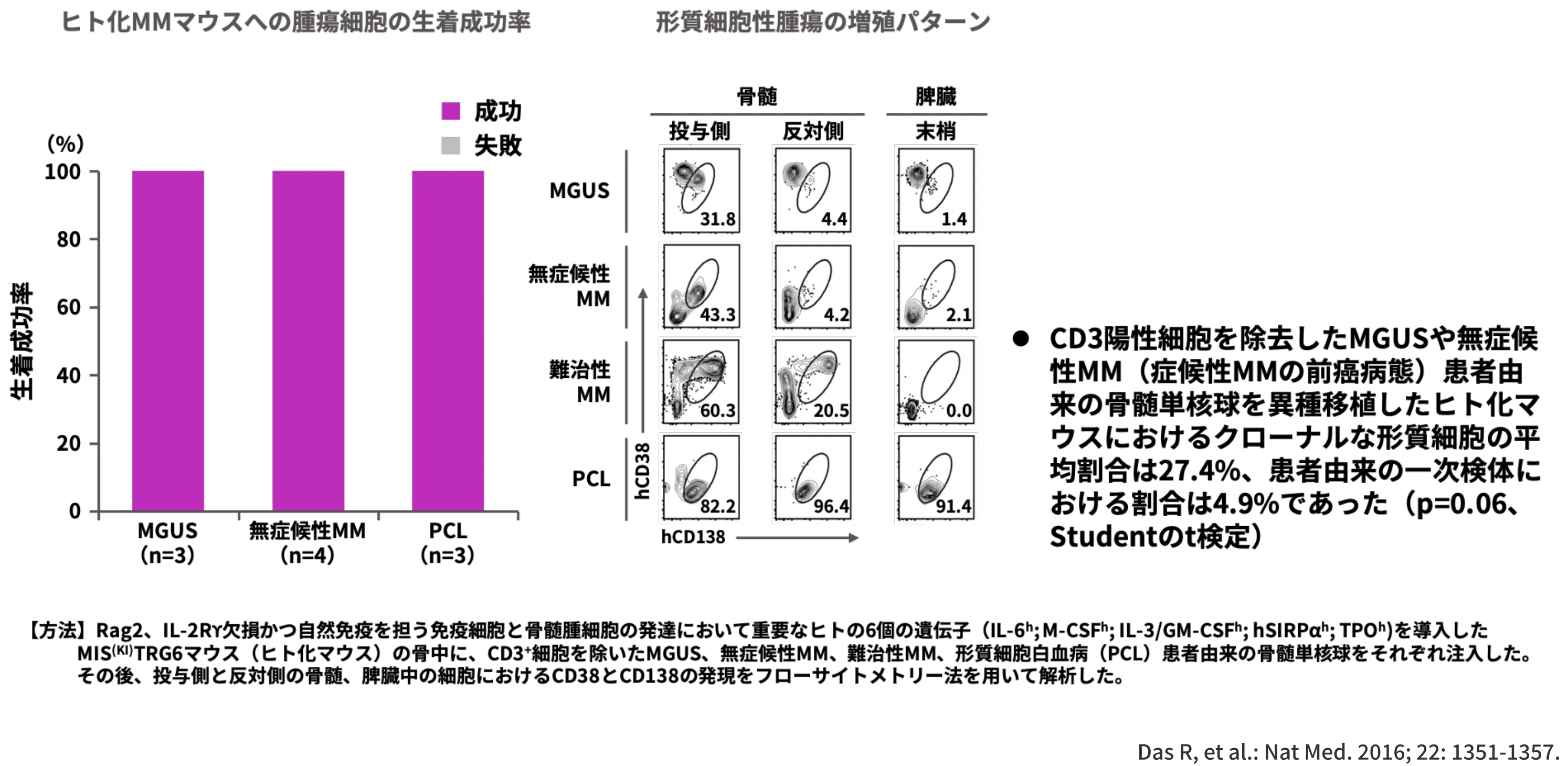
本研究では、ヒト化MM移植用モデルマウスの骨中に、CD3+細胞を除去したMGUS、無症候性MM、難治性MM、PCL患者由来の骨髄単核球を注入し、マウスの体内で腫瘍細胞が生着・増殖するかどうかが検討されました1)。
その結果、MGUS、無症候性MM、PCL患者由来の腫瘍細胞の生着成功率は100%であり、いずれの患者由来の腫瘍細胞も注入された側の骨内での増殖が確認されました1)。
なお、難治性MM患者由来の骨髄腫細胞の増殖は注入された側と反対の骨内でも認められ、PCL患者由来の腫瘍細胞増殖は髄外の末梢でも確認されました1)。
同研究において、CD3陽性細胞を除去したMGUSや無症候性MM(症候性MMの前癌病態)患者由来の⾻髄単核球を異種移植したヒト化マウスにおけるクローナルな形質細胞の平均割合が27.4%、一方患者由来の一次検体における割合が4.9%でした (p=0.06、Studentのt検定)1)。
以上より、MM進展に腫瘍外因性の要因(当研究ではCD3陽性細胞)が関与する可能性が示唆されました。
図:ヒト化マウスへのCD3陽性細胞を除去した患者由来(MGUS、無症候性MM、難治性MM、PCL)の骨髄単核球の異種移植後に骨髄腫細胞の生着や増殖が観察された(マウス)
引用
1)
Das R, et al.: Nat Med. 2016; 22: 1351-1357.
2)
Du F, et al.: Stem Cells Transl Med. 2021; 10: 598–609.
3)
Shinkai Y, et al.: Cell. 1992; 68: 855-867.
TregとCD3+ non-Tregを注入したマウスは、CD3+ non-Tregのみを注入したマウスと比較して生存期間が有意に短かった (p<0.01、log-rank検定)(マウス)1)
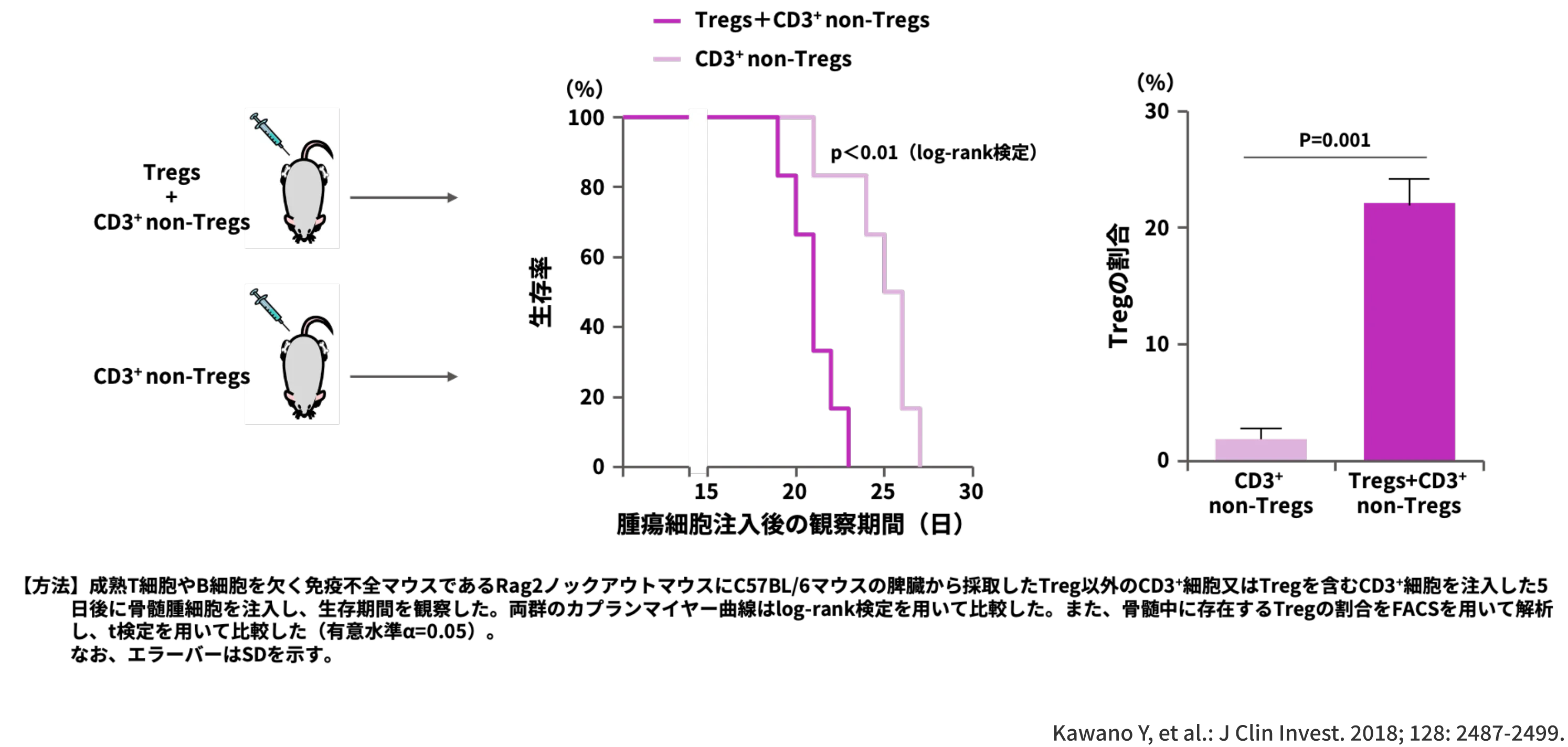
また、腫瘍免疫微小環境に存在する腫瘍細胞をサポートする因子としてTregが挙げられます1)。そこで、TregとMMの進行の関与を検討した報告をお示しします。
こちらは成熟T細胞やB細胞を欠く免疫不全マウスであるRag2ノックアウトマウスにC57BL/6マウスの脾臓から採取したTregを含むCD3+細胞又はTreg以外のCD3+細胞を注入した5日後に骨髄腫細胞を注入して、生存期間を比較した結果です1)。
TregとCD3+ non-Tregを注入したマウスの生存期間は、CD3+ non-Tregのみを注入したマウスの生存期間よりも有意に短く(p<0.01、log-rank検定)、骨髄中に存在するTregが増加していたことが示されました (p=0.001、t検定)1)。
このように、骨髄中に存在するTregはMMの進行に関与する可能性が示唆されました。
図:TregとCD3+ non-Tregを注入したマウスは、CD3+ non-Tregのみを注入したマウスと比較して生存期間が有意に短かった (p<0.01、log-rank検定)(マウス)
引用
1)
Kawano Y, et al.: J Clin Invest. 2018; 128: 2487-2499.
免疫抑制性の腫瘍免疫微小環境(TiME)には、エフェクター細胞の機能不全、免疫抑制細胞の産生や動員、可溶性の免疫抑制因子の3要因の相互作用が関わる1)
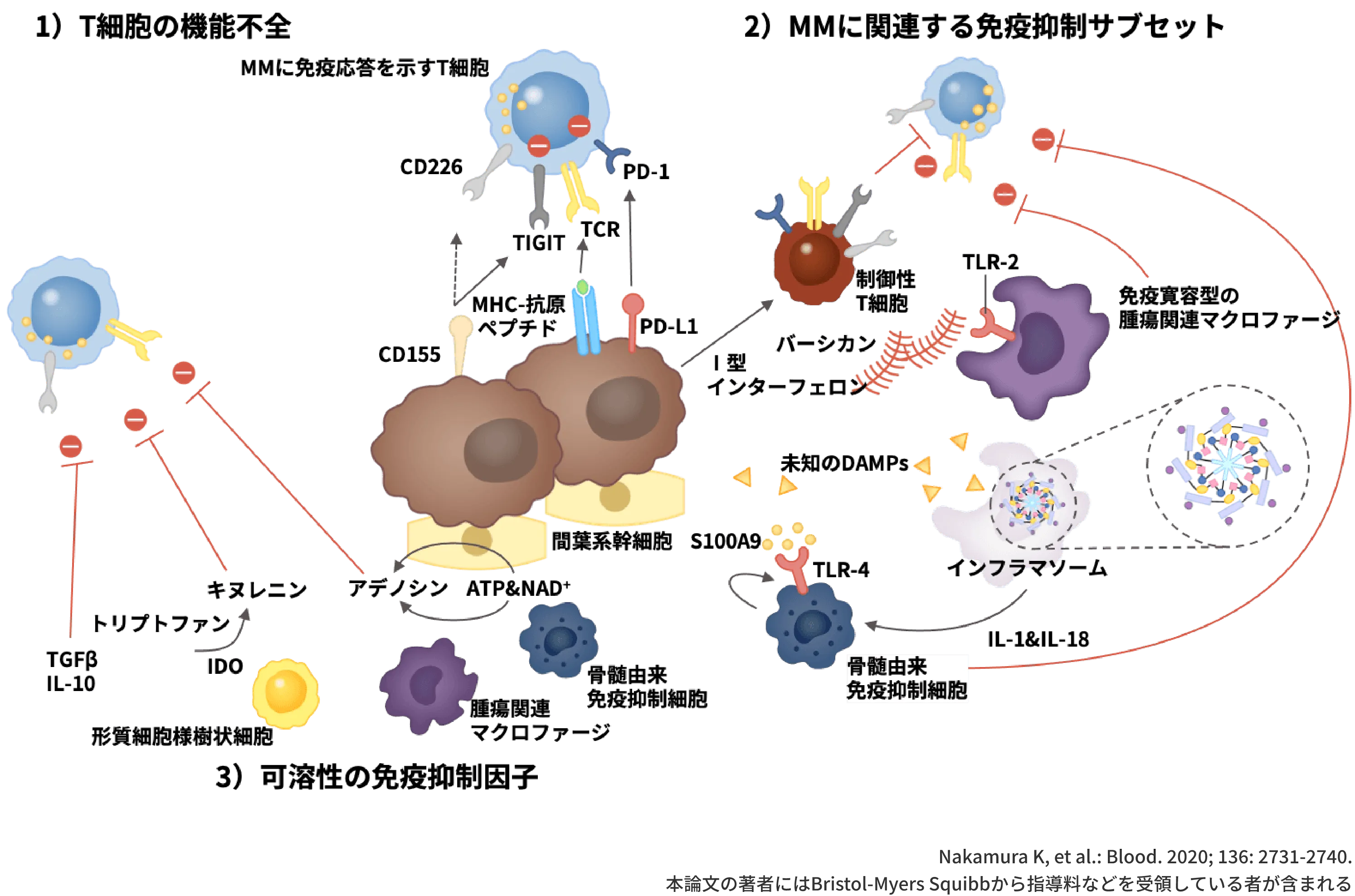
続いて、MMのTiMEで免疫抑制状態が誘導されるメカニズムについて、3つの観点からお示しします。
- 1つ目はエフェクターリンパ球の機能不全です。
エフェクターリンパ球の免疫応答は、活性型受容体と抑制型受容体のバランスによって制御されています。MM患者のリンパ球ではCD226をはじめとする活性型受容体の発現が低下する一方で、TIGITなどの抑制型受容体の発現が上昇しており、エフェクターリンパ球は疲弊状態になっていると考えられます1-3)。 - 2つ目は免疫抑制細胞の動員です。
MMのTiMEでは制御性T細胞(Treg)や骨髄由来免疫抑制細胞(MDSC)が増加しており、免疫寛容が誘導されていると考えられます1,2,4-6)。 - 3つ目は、可溶性の免疫抑制因子の作用です。
免疫抑制細胞が分泌するサイトカインや、トリプトファンやアデノシンの増加といった代謝物の異常がリンパ球の機能を低下させることが報告されています1,2,7-10)。
このように、免疫抑制状態のTiMEには様々な要因が含まれており、これらが組み合わさることで骨髄腫細胞がimmune escapeした状態になっていると考えられています。
図:免疫抑制性の腫瘍免疫微小環境(TiME)には、エフェクター細胞の機能不全、免疫抑制細胞の産生や動員、可溶性の免疫抑制因子の3要因の相互作用が関わる
引用
1)
Nakamura K, et al.: Blood. 2020; 136: 2731-2740.
2)
中村恭平.: 臨床血液. 2021; 62: 1186-1194.
3)
Guillerey C, et al.: Blood. 2018; 132: 1689-1694.
4)
Hope C, et al.: Blood. 2014; 123: 3305-3315.
5)
Ramachandran IR, et al.: J Immunol. 2013; 190: 3815-3823.
6)
Nakamura K, et al.: Cancer Cell. 2018; 33: 634-648. e5.
7)
Bonanno G, et al.: J Transl Med. 2012; 10: 247.
8)
Ray A, et al.: Leukemia. 2020; 34: 567-577.
9)
Vijayan D, et al.: Nat Rev Cancer. 2017; 17: 709-724.
10)
Nakamura K, et al.: Leukemia. 2020; 34: 2708-2721.
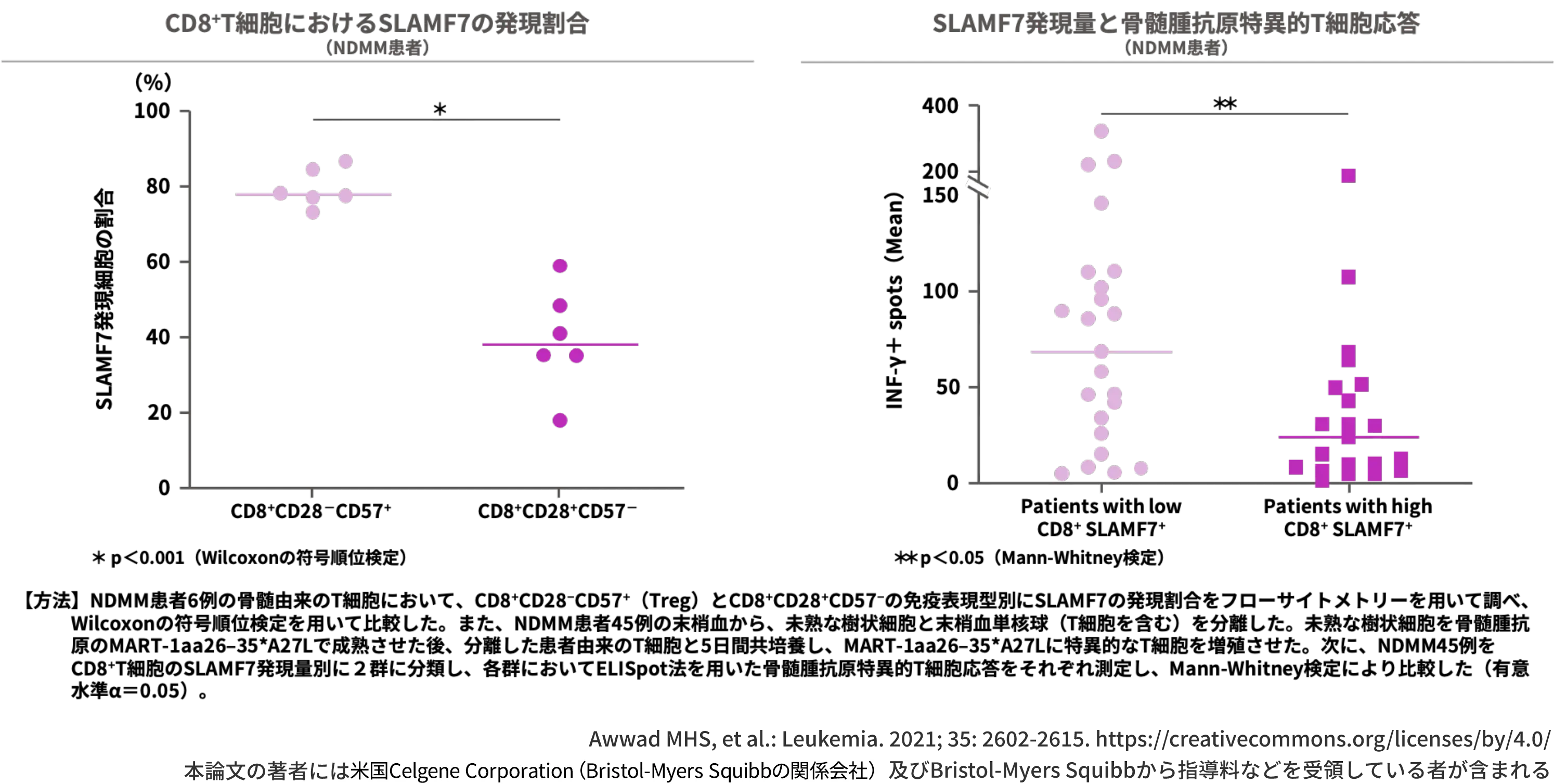
CD8+制御性T細胞(Treg)の約80%がSLAMF7を発現しており、SLAMF7とCD8が高発現の患者群では骨髄腫抗原特異的T細胞応答が有意に低かった(p<0.05、Mann-Whitney検定)(in vitro)1)
MMに関連する免疫抑制サブセットの一つとして、最近ではCD8陽性Tregが知られていますが2)、CD8陽性TregへのSLAMF7の関与が報告されています。
NDMM患者の骨髄由来のT細胞において、CD8+CD28−CD57+(CD8+Treg)とCD8+CD28+CD57−のCD8+T細胞におけるSLAMF7の発現割合を調べた結果、CD8+Tregの約80%にSLAMF7の発現が認められ、CD8+CD28+CD57−と比較してSLAMF7の発現が有意に高い結果でした (p<0.001、Wilcoxonの符号順位検定)1)。
また、SLAMF7とCD8が高発現の患者群では低発現の患者群と比較して、骨髄腫抗原特異的なT細胞応答が有意に低いことが示されました (p<0.05、Mann-Whitney検定)1)。
図:CD8+制御性T細胞(Treg)の約80%がSLAMF7を発現しており、SLAMF7とCD8が高発現の患者群では骨髄腫抗原特異的T細胞応答が有意に低かった(p<0.05、Mann-Whitney検定)(in vitro)
引用
1)
Awwad MHS, et al.: Leukemia. 2021; 35: 2602-2615.
2)
Plaumann J, et al.: Cancer Immunol Immunother. 2018; 67: 1695-1707.
3)
コスモ・バイオ株式会社.: ELISpot 原理とアプリケーション
(https://www.cosmobio.co.jp/support/technology/a/elispot.asp)(2025年7月アクセス)
4)
Czerkinsky C, et al.: J Immunol Methods. 1988; 110: 29-36.
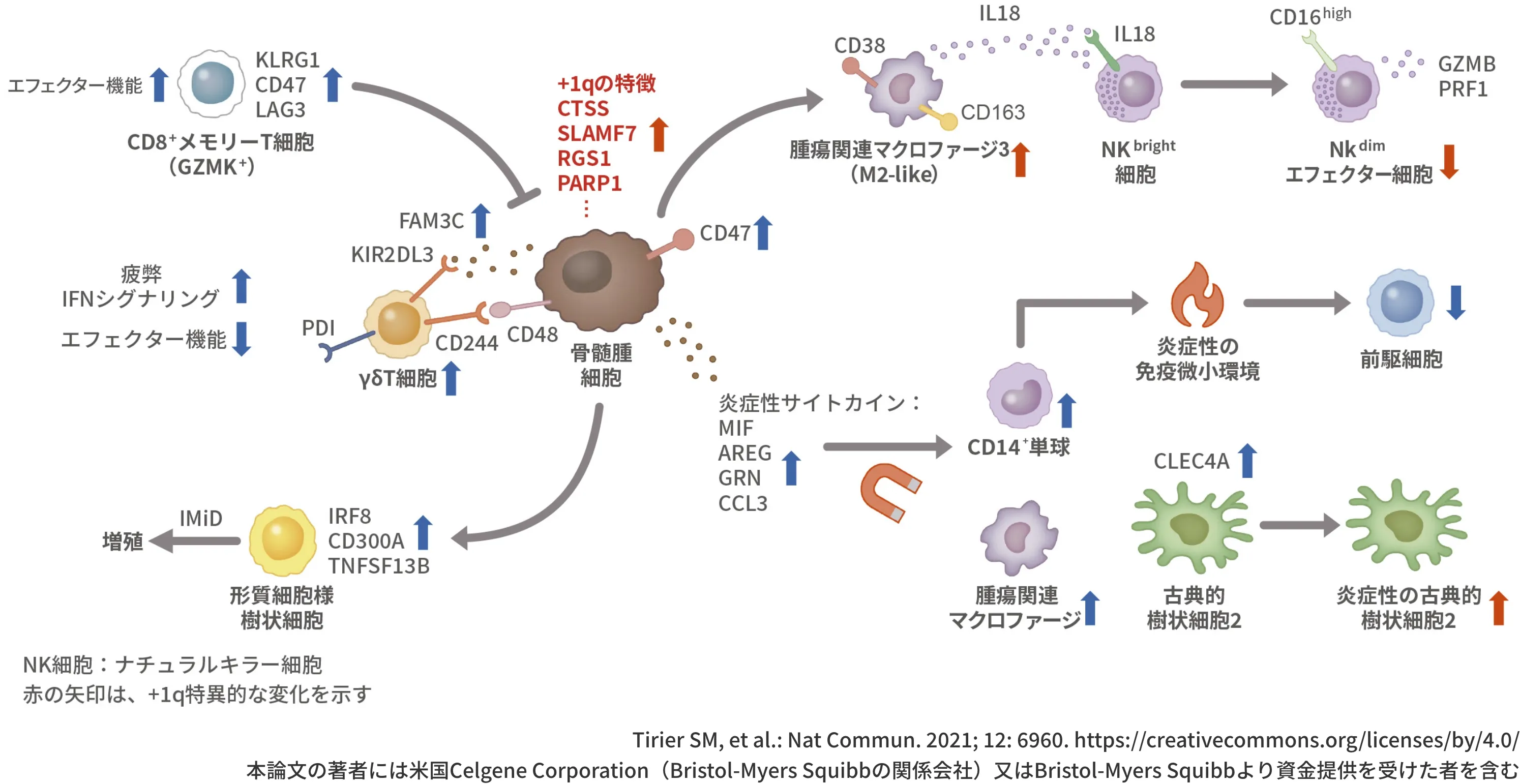
RRMM患者において、骨髄腫細胞と免疫微小環境の変化と
相互作用が観察された(モデル図)1)
治療前と再発後の骨髄サンプルを解析した研究から示された、RRMMの患者の腫瘍免疫微小環境における腫瘍細胞や免疫細胞の変化、そしてその関連性をモデル図で紹介します。
図:RRMM患者において、骨髄腫細胞と免疫微小環境の変化と相互作用が観察された(モデル図)
引用
1)
Tirier SM, et al.: Nat Commun. 2021; 12: 6960.
2025年11月作成
承認番号:HE-JP-250004620